
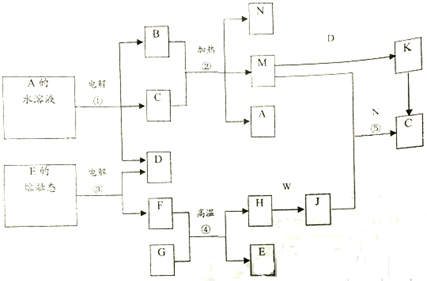
分析 A为硫酸盐,且溶液为蓝色,则A为CuSO4,电解生成硫酸、氧气和铜,B为常见的金属单质,所以B为Cu,D、K、M、W均是气体,所以D为O2,反应②为C的浓溶液与B在加热条件下的反应,应为铜与浓硫加热生成M为SO2,N为水,W为黄绿色,则W为Cl2;D与M反应生成K为SO3,G是一种具有磁性的黑色晶体,则G为Fe3O4,F、H为金属单质,所以F为Al,H为Fe,铁与氯气反应生成J为FeCl3,电解E的熔融态物质生成铝和氧气,所以E为Al2O3,结合对应物质的性质以及题目要求解答该题.
解答 解:A为硫酸盐,且溶液为蓝色,则A为CuSO4,电解生成硫酸、氧气和铜,B为常见的金属单质,所以B为Cu,D、K、M、W均是气体,所以D为O2,反应②为C的浓溶液与B在加热条件下的反应,应为铜与浓硫加热生成M为SO2,N为水,W为黄绿色,则W为Cl2;D与M反应生成K为SO3,G是一种具有磁性的黑色晶体,则G为Fe3O4,F、H为金属单质,所以F为Al,H为Fe,铁与氯气反应生成J为FeCl3,电解E的熔融态物质生成铝和氧气,所以E为Al2O3,
(1)由以上分析可知,E为Al2O3 ,
故答案为:Al2O3;
(2)反应②为铜与浓硫加热生成SO2,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,反应④为铝热反应,反应的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,反应⑤氯化铁与二氧化硫在水溶液中反应生成硫酸和氯化亚铁,反应的化学方程式为2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl;
(3)反应①为电解硫酸铜溶液,阳极产生氧气,阴极产生铜,根据电子得失守恒可知关系2Cu~O2,所以当阳极产生2.24L(标准状况下)即为0.1mol气体,阴极析出铜的质量为2×0.1mol×64g/mol=12.8g,
故答案为:12.8;
(4)SO2转化为SO3时,每生成1mol气态SO3,反应放出98.3kJ热量,则该反应的热化学方程式为2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1 ,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ•mol-1.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合运用,注意本题可根据物质的颜色、状态为突破口进行推断,明确物质的种类为解答该题的关键,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
2012年6月18日,“神舟九号”飞船上的宇航员成功进入“天宫一号”太空实验室,标志着我国航天事业新的飞跃。火箭和飞船飞行所需的巨大能量可由下列化学反应提供:
C2H8N2+2N2O4=2CO2↑+3N2↑+4H2O有关该反应的说法正确的是
A.由于化学键断裂,放出能量 B.氮元素的化合价不变
C.碳元素被氧化 D.还原剂是N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 及时除去二氧化碳,正反应速率加快 | |
| B. | 其它条件不变,加入催化剂,△H变大 | |
| C. | 增大压强,正反应速率增大,逆反应速率减小 | |
| D. | 降低温度,可提高反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+4H++4e-═2H2O | |
| C. | 粗铜精炼时,与电源正极相连是纯铜,电极反应式为Cu-2e-═Cu2+ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com