
 |  |  |  |
| A.读取确定终点时的数据为21.80mL | B.实验室制取氨气 | C.用苯萃取碘水中的I2后,分液 | D.配置0.10mol/L NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
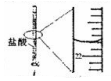
分析 A.滴定管中大刻度在下边,小刻度在上边;
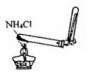
B.实验室制备氨气,应用氯化铵和氢氧化钙反应;
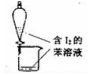
C.苯的密度比是小,在溶液的上层;
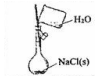
D.不能在容量瓶中溶解固体.
解答 解:A.滴定管中大刻度在下边,小刻度在上边,则由图中数据可知读取确定终点时的数据为21.80mL,故A正确;
B.只加热氯化铵不能得到氨气,实验室制备氨气,应用氯化铵和氢氧化钙反应,故B错误;
C.苯的密度比是小,在溶液的上层,从下层流出的为水层,故C错误;
D.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中溶解固体,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、基本操作、气体的制备等知识点,明确仪器使用方法、基本操作规范性是解本题关键,注意滴定管和量筒刻度区别,题目难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 90℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13:H2O(l?)H+(aq)+OH-(aq)△H<0 | |
| C. | 氨水中滴入酚酞溶液.溶液变红:NH3•H2O═NH4++OH- | |
| D. | 向澄清石灰水中通入过量CO2,溶液变浑浊:Ca2++CO2+2OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
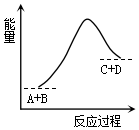
| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 该反应为放热反应 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、OH-、Na+ | B. | Fe2+、H+、Cl- | C. | Fe2+、OH-、NO3- | D. | Fe2+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
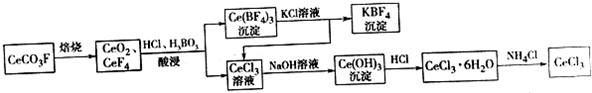
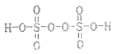 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棕红色NO2加压后颜色先变深后变浅 | |
| B. | 加催化剂,使 N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和NaOH固体快速制取氨气 | |
| D. | 加压条件下有利于SO2与O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
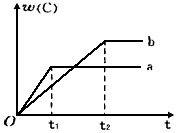 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 反应起始由逆反应开始建立平衡 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 若其它条件相同,a比b的温度高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com