
【题目】利用镁和稀硫酸反应,不仅可以测定1mol氢气的体积,装置如下左图,也可以测定镁带中镁的质量分数(杂质与酸反应不产生气体),装置如图。
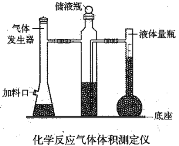

(1)用离子方程式表示测定实验的反应原理____________________________________。
(2)硫酸必须过量的目的是__________________________________________________。
(3)用“化学反应气体体积测定仪”测定1mol氢气的体积时,要三次用到注射器,其中两次是抽气调压,还有一次是___________________________________________。
(4)a(g)镁和足量稀硫酸反应,镁完全反应后,测得氢气在常温时的体积为V(L),则常温下l mol氢气的体积为_________________L。
(5)某学生在测定1molH2体积时,镁中混有少量铝,测定结果将_______________(填:偏大、偏小或没有变化)。
(6)若用“化学反应气体体积测定仪”也可以测定1mol二氧化碳气体的体积,那么储液瓶中应盛放________________________溶液。
(7)在“镁带中镁的质量分数测定装置”中,导管a的作用是______________________。
(8)“镁带中镁的质量分数测定”中,读取量气管的读数时,要使装置内外压强保持一致,具体操作为_________________________________________________________。
(9)在“镁带中镁的质量分数测定”中,如果实验的测定结果偏高,可能的原因是____________(选填编号)。
a.装置漏气 b.未冷却至室温即读数
c.镁带中含有氧化镁 d.末读数时量气管的液面低于水准管
【答案】Mg+2H+=Mg2++H2↑ 确保镁完全反应 加注稀硫酸 ![]() 偏大 饱和碳酸氢钠 使分液漏斗中的液体顺利滴入锥形瓶 上下移动量气管,使量气管液面和水准管内液面持平 bd
偏大 饱和碳酸氢钠 使分液漏斗中的液体顺利滴入锥形瓶 上下移动量气管,使量气管液面和水准管内液面持平 bd
【解析】
镁和稀硫酸反应生成硫酸镁和氢气;测定镁带中镁的质量分数时,镁必须反应完全;根据反应的方程式,结合镁的质量计算生成氢气的物质的量,进而计算1mol氢气的体积;二氧化碳应该不与储液瓶中盛装的溶液反应且不溶于储液瓶中盛装的溶液;导管a的作用是调节气压。
(1)测定实验的反应原理是镁和稀硫酸反应生成硫酸镁和氢气,其离子反应方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(2)镁与稀硫酸反应,为了确保镁完全反应,硫酸必须过量,故答案为:确保镁完全反应;
(3)用注射器量取一定体积的稀硫酸溶液并注入气体发生器,故答案为:加注稀硫酸;
(4)根据Mg+2H+=Mg2++H2↑,结合消耗的镁的质量可知,生成氢气的物质的量为![]() ,则常温下lmol氢气的体积为则
,则常温下lmol氢气的体积为则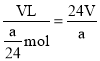 ,故答案为:
,故答案为:![]() ;
;
(5)根据Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,24g镁生成1mol氢气,18g铝生成1mol氢气,所以,镁中混有少量铝,测定结果将偏大,故答案为:偏大;
(6)CO2在饱和碳酸氢钠溶液中溶解度最小,所以储液瓶中应盛放饱和碳酸氢钠溶液;故答案为:饱和碳酸氢钠;
(7)导管a连接分液漏斗和锥形瓶,作用是调节气压,使分液漏斗中的液体顺利滴入锥形瓶,故答案为:使分液漏斗中的液体顺利滴入锥形瓶;
(8)要使装置内外压强保持一致,必须将量气管上下移动,使量气管液面和水准管内液面持平,故答案为:上下移动量气管,使量气管液面和水准管内液面持平;
(9)a. 装置漏气,导致氢气体积减小,测定结果偏低,a错误;
b. 未冷却至室温即读数,根据热胀冷缩,水中体积增大,气体体积减小,测定结果偏高,b正确;
c. 镁带中含有氧化镁,会导致生成氢气的气体减少,测定结果偏低,c错误;
d. 末读数时量气管的液面低于水准管,导致体积读大了,测定结果偏高,d正确;故答案为:bd。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是

A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是③
C.该历程中制约反应速率的方程式为CH3O*+3H* CO*+4H*
D.由此历程可知:![]() △H<0
△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
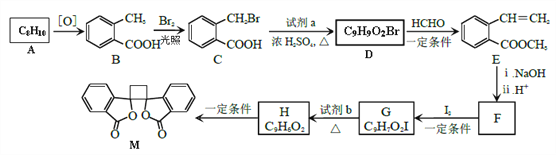
【题目】有机物M 有抗菌作用,其合成路线如下图所示:
已知:①![]()
②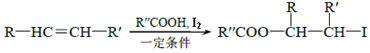
③
(1)M的分子式是______________,A的化学名称是__________________。
(2)G的结构简式是___________,F中含氧官能团的名称是_______________。
(3)由A生成B和由G生成H 的反应类型分别是___________、____________。
(4)由C生成D 的化学方程式是_________________。
(5)E 的同分异构体中,符合下列条件的结构共有___________种。
①苯的二元取代物 ②与E 具有相同的官能团 ③能发生银镜反应和水解反应
(6)结合题给信息,以甲苯为原料制备化合物![]() ,设计合成路线(其他试剂任选)。 _________
,设计合成路线(其他试剂任选)。 _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图装置,测定某种旧铝合金(含Al2O3和其它不溶于NaOH溶液的成分)中Al的质量分数,其中100mLNaOH溶液过量,每隔相同时间读得电子天平的数据如表:
称量对象 | 读数次数 | 质量(g) |
样品 | 第1次 | 2.582 |
锥形瓶+100mL NaOH溶液 | 第2次 | 185.721 |
锥形瓶+NaOH溶液+样品 | 第3次 | 188. 286 |
第4次 | 188. 254 | |
第5次 | 188. 243 | |
第6次 | 188. 243 |

(1)反应的化学方程式为_____________________________________________________、__________________________________________________。
(2)反应中产生的H2质量为___________________ g。
(3)样品中Al的质量分数为___________________(用小数表示,小数点后保留两位)。该小组为了测定其中Al2O3的含量,从上面反应后的100mL溶液中,取出10mL溶液,逐滴加入1mol/L的盐酸,当滴到5.00mL时开始产生沉淀,继续滴加盐酸,至25.00mL时沉淀恰好全部溶解。
(4)取出的10mL溶液中,AlO2-的物质的量浓度为_____________________________;
(5)Al2O3的质量分数_____________________(用小数表示,小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
(1)用编号为①、②、③、④、⑤的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2 和水蒸气.用装置的连接顺序(按产物气流从左到右的流向):______→______→______→______→______
①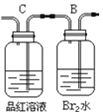 ②
②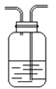 ③
③ ④
④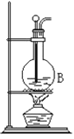 ⑤
⑤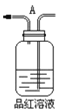
(2)实验的装置①中C瓶的现象是______;原因是_______
(3)B瓶中的现象是________;B瓶溶液作用为________
(4)若A瓶的现象是________,说明________
(5)装置③中加的固体药品是__________,以验证混合气体中有______装置②中盛的溶液是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一次有机化学课堂小组讨论中,某同学设计了下列合成路线,你认为不可行的是( )
A.用氯苯合成环己烯: ![]()
B.用甲苯合成苯甲醇: ![]()
C.用乙烯合成乙酸: C2H4![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH
CH3COOH
D.用乙烯合成乙二醇: H2C=CH2![]() CH3CH3
CH3CH3![]() CH2ClCH2Cl
CH2ClCH2Cl![]() HOCH2CH2OH
HOCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
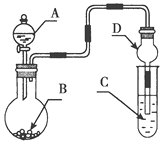
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com