
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | NaOH、H2SO4、Ba(OH)2 | D. | NaBr、H2SO4、Ba(OH)2 |
分析 在电解时电解水类型即只生成氢气和氧气,则溶液中氢离子在阴极放电,氢氧根离子在阳极放电,结合离子的放电顺序来解答.
解答 解:A.电解HCl生成氢气和氯气,电解CuCl2生成Cu和氯气,电解Ba(OH)2生成氢气和氧气,故A错误;
B.电解NaOH生成氢气和氧气,电解CuSO4生成Cu、氧气、硫酸,电解H2SO4生成氢气和氧气,故B错误;
C.电解NaOH、H2SO4、Ba(OH)2,均只生成氢气和氧气,故C正确;
D.电解NaBr生成氢气和单质溴,电解Na2SO4、Ba(OH)2,均只生成氢气和氧气,故D错误;
故选:C.
点评 本题考查电解原理,明确溶液中离子的放电顺序是解答本题的关键,注意常见的物质的电解及电极材料,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚和苯都能和溴水发生苯环上的取代反应 | |
| B. | 醇属于烃的衍生物,饱和一元醇的组成符合CnH2nO | |
| C. | 乙醇是无色透明的液体,密度比水小,能用乙醇从碘水中萃取出碘 | |
| D. | 向苯酚钠溶液中通入CO2气体,使溶液变浑浊,说明碳酸的酸性比苯酚的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/(L•min) | B. | 1 mol/(L•min) | C. | 2 mol/(L•min) | D. | 3 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY为0.3mol/L | B. | Y2为0.35mol/L | ||
| C. | X2为0.2mol/L | D. | X2、Y2、XY总浓度为0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
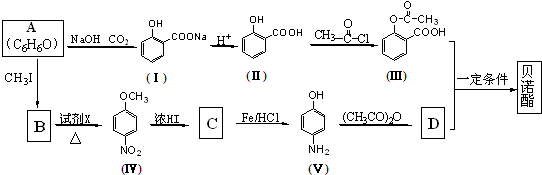
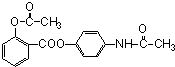
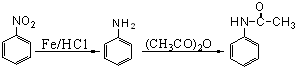
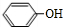 ;
;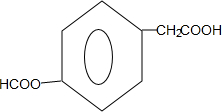 或
或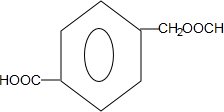 ;
;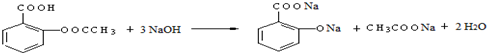 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的氢化物熔沸点比Z的氢化物熔沸点低 | |
| D. | Y与R形成的化合物YR的熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
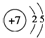 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com