
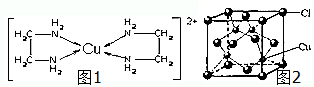
 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:分析 (1)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;同周期自左而右,电负性增大,据此判断O、N元素的电负性,H元素与O、N元素化合时,表现正化合价,H元素的电负性比O、N元素小;
(2)根据价层电子对互斥理论判断离子构型;
(3)根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4,离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型.
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+.
解答 解:(1)铜的原子序数为29,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1,故铜原子基态外围电子排布式为3d104s1;
同周期自左而右,电负性增大,电负性O>N,H元素与O、N元素化合时,H元素表现正化合价,H元素的电负性比O、N元素小,故电负性O>N>H.
故答案为:3d104s1;O>N>H;
(2)SO42-离子中价层电子对数为4+$\frac{1}{2}$(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型,
故答案为:正四面体型;
(3)乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD.
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+,
故答案为:4.
点评 本题考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH试纸测得某新制氯水的pH值为9 | |
| B. | 用标准盐酸溶液滴定一定体积的待测NaOH溶液时,用石蕊做指示剂 | |
| C. | 用碱式滴定管量取高锰酸钾溶液5.10 mL | |
| D. | 用10 mL的量筒量取8.5 mL浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 能量变化是化学反应的基本特征之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 .
. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
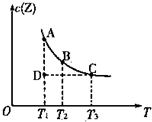 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ⑤ | C. | ②⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com