
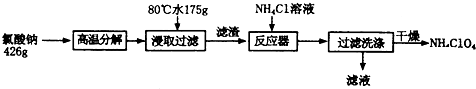
分析 据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,过滤洗涤干燥就可以得到高氯酸铵的固体.
(1)根据题干信息:氯酸钠受热分解生成高氯酸钠和氯化钠来书写方程式;
(2)根据温度和物质的溶解度的关系知道:高氯酸钠的溶解度受温度影响大,但是氯化钠的溶解度受温度影响不大;
(3)向高氯酸钠中加入氯化铵,沉淀向着更难溶的物质转化;
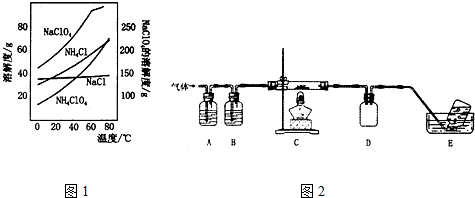
(4)氯气能被NaOH吸收,水可以被浓硫酸吸收,氧气可以被热的Cu吸收,氮气可以用排水法收集,氢氧化钠中有水,先是吸收氯气,再是将水吸收,最后吸水的是氧气,所以A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,最后用排水法收集氮气,据此分析;
(5)过滤用到的主要玻璃仪器是玻璃棒、烧杯和漏斗.
解答 解:(1)根据氧化还原反应原理和信息,氯酸钠受热分解生成高氯酸钠和氯化钠,得到方程式为4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl,
故答案为:4NaClO3$\frac{\underline{\;\;△\;\;}}{\;}$3NaClO4+NaCl;
(2)可由图知,NaClO4的溶解度受温度影响很大,NaCl溶解度受温度影响不大,80℃时浸取液冷却至0℃过滤,高氯酸钠的溶解度迅速降低,析出晶体,但是氯化钠的溶解度受温度的影响不大,不会析出晶体,故答案为:NaClO4;
(3)反应器高氯酸钠中加入氯化铵饱和溶液,反应向着更难溶的物质转化,根据物质的溶解情况,可以知道会析出高氯酸铵,即发生反应的离子方
程式为NH4++ClO4-=NH4ClO4,故答案为:NH4++ClO4-=NH4ClO4;
(4)氯气能被NaOH吸收,水可以被浓硫酸吸收,氧气可以被热的Cu吸收,氮气可以用排水法收集,氢氧化钠中有水,先是吸收氯气,再是将水吸收,最后吸水的是氧气,所以A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,最后用排水法收集氮气,
①E中收集到的气体只能是氮气,故答案为:N2;
②A、B、C中盛放的药品依次可以是c.NaOH b.浓H2SO4 e.Cu,故答案为:Ⅱ;
(5)过滤用到的主要玻璃仪器是玻璃棒、烧杯和漏斗,故答案为:玻璃棒、烧杯和漏斗.
点评 本题是一道物质的分离和提纯的实验方案设计题,考查学生分析和解决问题的能力,难度大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:简答题
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
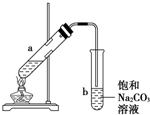 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
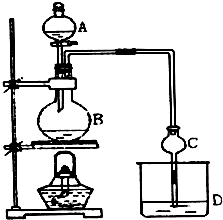 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾净水时使水中悬浮颗粒沉淀 | |
| B. | 清晨树林中的道道光柱 | |
| C. | 雾霾天气打手电能看到明显的光柱 | |
| D. | 澄清石灰水中通入CO2气体,有白色的沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com