
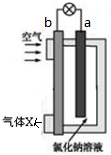
| A. | 工作一段时间后,c(Na+)变大 | |
| B. | 电池工作时,OH-向a极移动 | |
| C. | 气体X 中N2的百分含量与空气相同 | |
| D. | 电池总反应为2Mg+O2+2H2O═2 Mg(OH)2 |
分析 该原电池中,发生吸氧腐蚀,Mg易失电子作负极,根据图知,a是负极、b是正极,负极反应式为Mg-2e-=Mg2+,正极反应式为O2+2H2O+4e-═4OH-,镁离子和氢氧根离子反应生成Mg(OH)2,所以电池反应式为2Mg+O2+2H2O═2Mg(OH)2,放电时,电解质溶液中阴离子向负极移动、阳离子向正极移动,据此分析解答.
解答 解:A.该原电池中钠离子不参加反应,但水参加反应导致体积减小,所以c(Na+)增大,故A正确;
B.Mg易失电子作负极,通入空气的电极是正极,放电时OH-向负极a极移动和镁离子结合生成 Mg(OH)2,故B正确;
C.原电池工作时消耗空气中的氧气,则气体X中N2的百分量大于空气,故C错误;
D.负极反应式为Mg-2e-=Mg2+,正极反应式为O2+2H2O+4e-═4OH-,镁离子和氢氧根离子反应生成Mg(OH)2,所以电池反应式为2Mg+O2+2H2O═2Mg(OH)2,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应及离子移动方向是解本题关键,注意:镁离子和氢氧根离子不共存,二者反应生成氢氧化镁沉淀.


科目:高中化学 来源: 题型:选择题
| A. | 9 | B. | 12 | C. | 18 | D. | 24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1 mol•L-1 CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| C. | pH相同的①CH3COONa②NaHCO3两份溶液中的c(Na+):①<② | |
| D. | 用NaOH溶液滴定CH3COOH溶液至pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 评价 |
| A | 除去溴苯中的少量溴单质:用NaOH溶液洗涤、分液 | 错误,Br2不会与NaOH溶液反应 |
| B | 分离乙醇和乙酸:加入过量氢氧化钠,蒸馏分离出乙醇,再加入过量浓硫酸,蒸馏分离出乙酸 | 错误,直接蒸馏即可分离得到纯净的乙醇和乙酸 |
| C | 提取饱和碘水中的碘单质:用乙醇萃取 | 正确,单质碘易溶于乙醇等有机溶剂 |
| D | 除去乙烷中混有的少量乙烯:用溴水洗气 | 正确,乙烯能与溴水发生加成反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴易挥发,实验室保存液溴时要密封保存,且加少量水进行液封 | |
| B. | 氯化钠中混有少量单质碘杂质,可用升华的方法提纯 | |
| C. | 保存FeCl2溶液时,通常在溶液中加少量的单质铁 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,要将NaOH固体放在滤纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、玻璃、水晶饰物都是硅酸盐制品 | |
| B. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| C. | 光导纤维的主要成分是SiO2 | |
| D. | 自然界中硅元素的贮量丰富,并存在大量的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a-4 | B. | a+8 | C. | a-5 | D. | a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>戊烷>2甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<1,1,2,2四溴乙烷 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com