
下列关于硫酸工业生产过程的叙述错误的是
A.在接触室中使用铁粉作催化剂
B.在接触室中运用热交换技术可充分利用能源
C.把硫铁矿磨成细粉末,可以提高原料的利用率
D.该反应采用450-500℃主要是因为该温度下催化剂活性好
科目:高中化学 来源: 题型:
克砂平是治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):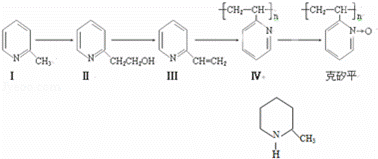
(1)化合物I的分子式为 ,其某些化学性质类似于苯.例如,化合物I可在一定条件下与氢气发生加成反应生成如图物质其反应方程式(不要求标出反应条件)为:
(2)化合物I生成化合物II是原子利用率为100%的反应,所需另一反应物的结构简式为:
(3)下列关于化合物II和化合物III的化学性质,说法正确的是 (填字母)
A.化合物II可以与CH3COOH发生酯化反应 B.化合物II不可以与金属Na生成氢气
C.化合物II不可以使酸性高锰酸钾溶液褪色D.化合物III可以使溴的四氯化碳溶液褪色 E.化合物III是芳香烃
(4)化合物III生成化合物Ⅳ的反应方程式为(不要求标出反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
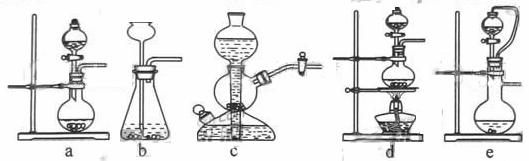
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
41.若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠
g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g (保留一位小数)。
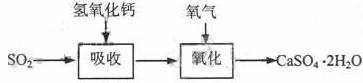
42.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
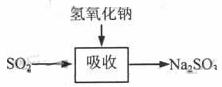
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.90 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
43.在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、熔化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2⇌ CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLzxxk
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com