
 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
分析 (1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水;根据分液漏斗的使用方法解答;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl;C中若发生堵塞,则B中长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合,注意Ⅱ中干燥剂为固态;
(4)将Cl2通入溴化亚铁溶液中,由于Fe2+的还原性比Br-的还原性强,所以发生反应有以下顺序:Cl2+2Fe2+═2Fe3++2Cl-;Cl2+2Br-═Br2+2Cl-;所以通入氯气的过程中先生成铁离子,后生成溴,溴溶于四氯化碳,颜色为红褐色.Fe3+的不溶于四氯化碳,但溶于水,水溶液是黄色;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,可能生成二氧化硫,污染环境.
解答 解:(1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水,该反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
使用分液漏斗滴加液体的方法为:打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液,
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl,则装置B的作用为除去氯气中的HCl;C中若发生堵塞,生成的氯气使B中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱,
故答案为:除去氯气中的HCl;B中长颈漏斗下端导管中液面会上升,形成水柱;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有D符合,
故答案为:D;
(4)A.Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应,而且生成的Fe3+不再与溶液中的其他物质发生反应,因此从反应开始自始至终溶液中都有Fe3+,溶液始终为黄色,故A正确;
B.根据对A的分析可知水层为黄色,故B错误;
C.根据Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应Cl2+2Br-═Br2+2Cl-;因此刚开始时四氯化碳层是无色的,当有溴生成时四氯化碳层才变为红棕色.故C错误;
D.根据对C的分析,当有溴产生时四氯化碳层就变为红棕色,故D错误;
故答案为:A;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,
故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,反应的离子反应为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O),可能生成二氧化硫,污染环境,则不能用NaHSO3溶液吸收尾气,
故答案为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O);否.
点评 本题考查了物质制备、性质实验方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,注意熟练掌握物质性质、制备方案的设计原则.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
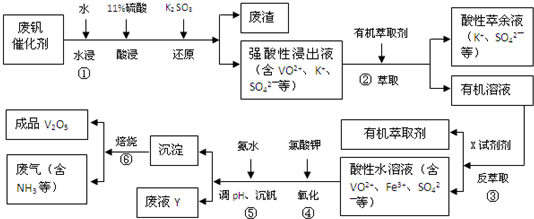
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验方法 | 实验现象 | 实验结论 |
| 1.取反应初始阶段(氯气不足量)E中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液,①加入KSCN溶液,②加入KMnO4溶液 | ① ② | 生成物中没有FeCl2 生成物中含有FeCl3 |
| 2.取充分反应后(氯气通入足够长时间)E中产物,溶于水中,加入KMnO4溶液 | KSCN溶液显红色, KMnO4溶液不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com