
| 6.44KJ |
| 0.14mol |
| 3.1-x |
| 3.4 |
| x-0.3 |
| 3.4 |
| 0.6 |
| 3.4 |
| 0.3L |
| 1L |
| 6.44KJ |
| 0.14mol |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
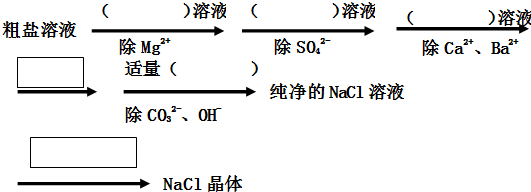
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、NO3- |
| C、K+、Fe2+、Cl-、MnO4- |
| D、Ca2+、Na+、Fe3+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯和水,酒精和水,植物油和水 |
| B、四氯化碳和水,溴苯和水,硝基苯和水 |
| C、甘油和水,乙酸和水,乙酸和乙醇 |
| D、酒精和水,苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:

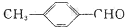 中的含氧官能团,请写出该反应的化学方程式:
中的含氧官能团,请写出该反应的化学方程式: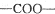 结构的基团
结构的基团查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H11OH |
| B、C6H13OH |
| C、C7H15OH |
| D、C8H17OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com