
【题目】工业生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)![]() C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量
D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
科目:高中化学 来源: 题型:
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物在工业上有重要的应用.
(1)FeCl3净水的原理是(用离子方程式表示)_________________.FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)________________.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3.
①若酸性FeCl2废液中c(Fe2+)=2.0×10﹣2molL﹣1,c(Fe3+)=1.0×10﹣3molL﹣1,c(Cl﹣)=5.3×10﹣2molL﹣1,则该溶液的PH约为_____.
②完成NaClO3 氧化FeCl2 的离子方程式:
ClO3﹣ +___Fe2+ +___ ____= __Cl﹣ + ___Fe3++ __ ____.
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如图1所示:反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明__________________________.某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO﹣与ClO3﹣离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为_____.
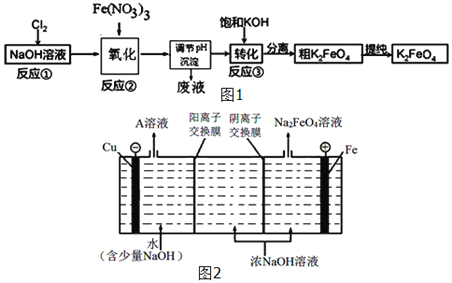
(4)工业上还可用通过电解浓NaOH溶液来制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年1月3日晨,昆明长水国际机场出现大雾天气,导致大量航班延误。雾属于下列哪种分散系( )
A. 乳浊液 B. 溶液 C. 悬浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解下列溶液
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)_______。
(2)阴极、阳极都有气体产生,其中溶液pH变大的是________。(填序号)
(3)一个电极析出金属,一个电极逸出气体,且溶液pH明显减小的是________ (填序号),其总反应的化学方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是()
A.除去溴苯中混有的少量溴单质:加入足量的氢氧化钠溶液,振荡静置分液
B.除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀
C.除去乙醇中的微量水,可加入金属钠,使其完全反应
D.除去乙酸乙酯中的乙酸,加入碳酸钠溶液洗涤,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需加入还原剂的是 ( )
A. HCO3-→CO2 B. MnO4-→Mn2+ C. FeO→Fe3O4 D. H3AlO3→HAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在无色溶液中能大量共存的是( )
A. Fe3+、NH4+、OH-、Cl- B. Na+、H+、NO3-、SO42-
C. Fe2+、Fe3+、Na+、NO3- D. Fe2+、NH4+、Cl-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com