
分析 (1)A.酒精在桌面上燃烧起来,应立即用湿抹布灭火,不能用水灭火;
B.不慎将酸沾到皮肤或衣物上,应立即用水冲洗;
C.NaOH固体具有强腐蚀性,易潮解;
D.实验剩余的药品一般不能放回原试剂瓶,防止污染;
E.分液时应注意防止液体重新混合而污染;
F.带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水;
G.蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干;
(2)①根据配制溶液的实验操作过程选择所需的仪器来判断;
②再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,根据所需浓硫酸的体积选择量筒规格.
解答 解:(1)A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抹布灭火,不能用水灭火,故A正确;
B.不慎将酸沾到皮肤或衣物上,应立即用水冲洗,然后涂上适量的碳酸氢钠溶液,而NaOH为强碱具有腐蚀性,故B错误;
C.NaOH固体具有强腐蚀性,易潮解,要放在玻璃器皿中称量,不可直接放在纸上称量,故C错误;
D.实验剩余的药品一般不能放回原试剂瓶,防止污染,特殊的药品如钠等放回原试剂瓶,故D错误;
E.分液时应注意防止液体重新混合而污染,则分液漏斗下层液体从下口放出,上层液体从上口倒出,故E正确;
F.分液漏斗是带有旋塞和瓶塞的仪器,使用前需要检查是否漏水,故F正确;
G.蒸发时待大量晶体析出时,停止加热,利用蒸发皿的余热把剩余的水蒸干,故G错误;
故答案为:AEF;
(2)解:(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知不需要的仪器有:b.烧瓶 d.药匙 f.托盘天平;还需要仪器有:100mL容量瓶、玻璃棒;
故答案为:bdf;100mL容量瓶、玻璃棒;
(2)根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4.所需浓硫酸的体积为5.4mL;量筒规格越接近所需浓硫酸体积误差越小,所以选择10mL量筒.
故答案为:5.4;a.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,难度不大,明确配制方法为解答关键,注意掌握误差分析的方法与技巧,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
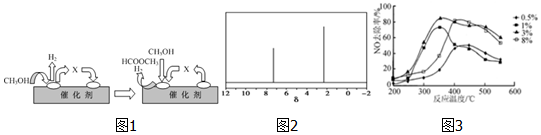
 CH3OH.
CH3OH. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 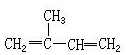 2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | B. | 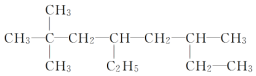 2,2-二甲基-4,6-二乙基庚烷 2,2-二甲基-4,6-二乙基庚烷 | ||
| C. |  1,3,4-三甲苯 1,3,4-三甲苯 | D. |  2-甲基-3-戊烯 2-甲基-3-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
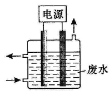 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com