
工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
某温度和压强条件下,分别将0.3 mol SiCl4(g)、0.2 mol N2(g)、0.6 mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得Si3N4(s)的质量是5.60 g。
(1)H2的平均反应速率是 mol·L-1·min-1。
(2)平衡时容器内N2的浓度是 mol·L-1。
(3)SiCl4(g)的转化率是 。
(4)若按n(SiCl4)∶n(N2)∶n(H2)=3∶2∶6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”“减小”或“不变”)。
(5)在不改变反应条件的情况下,为了提高SiCl4(g)的转化率,可通过改变投料配比的方式来实现。下列四种投料方式,其中可行的是 。
选项投料方式
An(SiCl4)∶n(N2)∶n(H2)=1∶1∶2
Bn(SiCl4)∶n(N2)∶n(H2)= 1∶2∶2
Cn(SiCl4)∶n(N2)∶n(H2)= 3∶2∶2
Dn(SiCl4)∶n(N2)∶n(H2)= 2∶1∶3
(6)达到平衡后升高温度,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(HCl)减少
B.正反应速率减慢,逆反应速率加快
C.Si3N4的物质的量减小
D.重新平衡时c(H2)/c(HCl)增大
(1)0.048 (2)0.06 (3)40% (4)减小 (5)A、B (6)A、C、D
【解析】依据“三部曲”计算
3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g)
Si3N4(s)+12HCl(g)
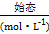 :0.150.10.30
:0.150.10.30
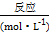 :0.060.040.120.24
:0.060.040.120.24
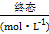 :0.090.060.180.24
:0.090.060.180.24
(4)相当于加压,平衡左移;(5)A、B、C、D的投料比分别为3∶3∶6、3∶6∶6、3∶2∶2、3∶1.5∶4.5,A、B、C、D分别相当于在3∶2∶6的投料配比基础上增加N2、增加N2、减少H2、减少N2和H2;(6)升高温度不论平衡向哪个方向移动,正逆反应速率均增大,B错误;升高温度,平衡左移,c(H2)增大,c(HCl)减小,A、C、D正确


科目:高中化学 来源: 题型:
| 高温 |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |


查看答案和解析>>
科目:高中化学 来源: 题型:


| 高温 |
| 选项 | 投料方式 |
| A | n(SiCl4):n(N2):n(H2)=1:1:2 |
| B | n(SiCl4):n(N2):n(H2)=1:2:2 |
| C | n(SiCl4):n(N2):n(H2)=3:2:2 |
| D | n(SiCl4):n(N2):n(H2)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源:2013届江苏省盐城市明达中学高三上学期学情调研考试化学试卷(带解析) 题型:填空题
(10 分)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了1.40g,则SiCl4的平均反应速率为 ;该反应的平衡常数表达式为 。
(2)上述反应达到平衡后,下列说法正确的是
a.其他条件不变,温度升高,平衡常数K减小
b.其他条件不变,压强增大,平衡向正反应方向移动
c.其他条件不变,增大SiCl4物质的量,平衡向正反应方向移动
d.其他条件不变,增大Si3N4物质的量,平衡向逆反应方向移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是
a.v逆(N2)=3v正(H2) b.v正(HCl)=4v逆(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新德平衡时,H2和HCl的物质的量之比 m/n(填“>”“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com