
 )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名. 分析 分子式为C5H11Cl的有机物,分析数据表明,分子中有两个甲基,两个亚甲基(-CH2-),一个次甲基( )及一个氯原子,两个甲基和一个氯原子只能位于边上,两个亚甲基只能连接两个原子或原子团,一个次亚甲基连接3个原子或原子团,根据各个基团连接的原子或原子团个数判断其结构,根据系统命名法命名.
)及一个氯原子,两个甲基和一个氯原子只能位于边上,两个亚甲基只能连接两个原子或原子团,一个次亚甲基连接3个原子或原子团,根据各个基团连接的原子或原子团个数判断其结构,根据系统命名法命名.
解答 解:分子式为C5H11Cl的有机物,分析数据表明,分子中有两个甲基,两个亚甲基(-CH2-),一个次甲基( )及一个氯原子,两个甲基和一个氯原子只能位于边上,两个亚甲基只能连接两个原子或原子团,一个次亚甲基连接3个原子或原子团,则符合条件的结构简式为:CH3CH2CHClCH2CH3(3-氯戊烷)、CH3CH2CH2CHClCH3(2-氯戊烷)、(CH3)2CHCH2 CH2Cl(1-氯-3-甲基丁烷)、CH3CH2CH(CH3)CH2Cl(1-氯-2-甲基丁烷);
)及一个氯原子,两个甲基和一个氯原子只能位于边上,两个亚甲基只能连接两个原子或原子团,一个次亚甲基连接3个原子或原子团,则符合条件的结构简式为:CH3CH2CHClCH2CH3(3-氯戊烷)、CH3CH2CH2CHClCH3(2-氯戊烷)、(CH3)2CHCH2 CH2Cl(1-氯-3-甲基丁烷)、CH3CH2CH(CH3)CH2Cl(1-氯-2-甲基丁烷);
故答案为:CH3CH2CHClCH2CH3(3-氯戊烷)、CH3CH2CH2CHClCH3(2-氯戊烷)、(CH3)2CHCH2 CH2Cl(1-氯-3-甲基丁烷)、CH3CH2CH(CH3)CH2Cl(1-氯-2-甲基丁烷);
点评 本题考查氯代物的同分异构体的判断,难度不大,掌握同分异构体的书写是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 1L该溶液中含KNO3 101g | |
| B. | 100mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500mL后,剩余溶液的浓度为0.05mol/L | |
| D. | 1L水中溶解0.1mol KNO3,即可配得0.1mol/L KNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成 | |
| B. | 质子数相同的粒子其化学性质不一定相同 | |
| C. | 某种粒子最外层上有8个电子,则一定是稀有气体元素的原子 | |
| D. | 原子电子构型为ns2np6的为稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨会产生白烟 | B. | 该反应利用了氯气的强氧化性 | ||
| C. | 该反应属于复分解反应 | D. | 生成1 mol N2有6 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温下,将容器体积变为原来2倍,CO的平衡浓度变为原来的$\frac{1}{2}$ | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,正反应速率减小,逆反应速率增大 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
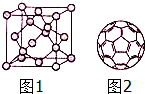 碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义.
碳及化合物与人类的关系非常密切,对碳单质及其化合物的研究具有重要意义. 2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).
2Na2CO3+C;CO32-的空间构型为平面正三角形(用文字描述).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
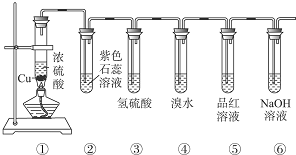
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com