
【题目】已知几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8。
I.(1)常温下,0.1mol·L-1的下列三种溶液:①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液, 其pH由大到小的顺序是________________(填序号);
(2)往NaClO溶液中通入少量CO2的离子反应方程式为___________________________________;
II. 常温下,在25.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液的pH变化曲线如图所示。
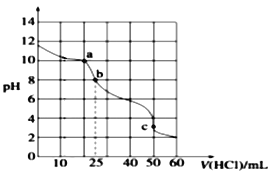
(3)a点溶液中c(CO32-) :c(HCO3-) =______________。
(4)b点溶液中溶质为______________。b点溶液呈碱性的原因为_______________________。
(5)b→c过程中的离子反应方程式为___________________________________________。
III. 现有某碳酸钠和氢氧化钠的混合溶液,为测定其中各成分的浓度,某实验小组设计了如下方案,步骤如下(结合上图回答下列问题):
①量取20.00mL样品溶液于锥形瓶中,加入几滴酚酞;
②用c mol·L-1的标准盐酸溶液滴定至终点;
③重复两次实验,消耗盐酸的体积平均值为V1 mL;
④另取20.00mL样品溶液于锥形瓶中,加入几滴甲基橙;
⑤用c mol·L-1的标准盐酸溶液滴定至终点;
⑥重复两次实验,消耗盐酸的体积平均值为V2 mL;
(6)步骤①中量取样品溶液所用仪器为___________________。
(7)步骤②终点现象为________________________________________________________________。
(8)样品溶液中碳酸钠和氢氧化钠物质的量浓度之比为___________。(用含c、V1、V2的式子表示),若步骤⑥中滴定结束时仰视读数,所得c(Na2CO3)_____(选填“偏大”、“偏小”、“不影响”)。
【答案】 ②③① CO2 + ClO- + H2O = HClO + HCO3- 0.47 NaHCO3 NaCl HCO3-水解程度大于其电离程度 H++ HCO3- = H2O + CO2↑ 碱式滴定管 滴入最后一滴盐酸,溶液由红色变为无色 (V2-V1)/(2V1-V2) 偏大
【解析】I.(1)根据几种酸的电离常数如下:K(CH3COOH)=1.8×10-5; K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8可知,酸性:CH3COOH>H2CO3>HClO>HCO3-。酸性越强,水解程度越小,溶液的碱性越弱,常温下,0.1mol·L-1的①CH3COONa溶液 ②Na2CO3溶液 ③NaClO溶液,pH由大到小的顺序是②③①,故答案为:②③①;
(2)往NaClO溶液中通入少量CO2反应生成碳酸氢钠和次氯酸,反应的离子反应方程式为CO2 + ClO- + H2O = HClO + HCO3-,故答案为:CO2 + ClO- + H2O = HClO + HCO3-;
II.(3)a点溶液为碳酸钠、碳酸氢钠和氯化钠的混合物,K2(H2CO3) =4.7×10-11= =
=  ,解得
,解得 =0.47,故答案为:0.47;
=0.47,故答案为:0.47;
(4)b点恰好反应生成碳酸氢钠和氯化钠。碳酸氢钠水解程度大于电离程度,溶液显碱性,故答案为:NaHCO3 NaCl;HCO3-水解程度大于其电离程度;
(5)b点恰好反应生成碳酸氢钠和氯化钠,b→c过程中继续加入盐酸,碳酸氢钠与盐酸反应生成二氧化碳和水,反应的离子反应方程式为H++ HCO3- = H2O + CO2↑,故答案为:H++ HCO3- = H2O + CO2↑;
III.(6)碳酸钠和氢氧化钠的混合溶液显碱性,步骤①中量取样品溶液所用仪器为碱式滴定管,故答案为:碱式滴定管;
(7)用盐酸滴定碳酸钠和氢氧化钠溶液,选用酚酞作指示剂,滴定终点现象为滴入最后一滴盐酸,溶液由红色变为无色,故答案为:滴入最后一滴盐酸,溶液由红色变为无色;
(8)用酚酞作指示剂是滴定的物质为氢氧化钠,同时碳酸钠转化为碳酸氢钠,再用甲基橙作指示剂滴定碳酸钠和氢氧化钠,碳酸钠转化为二氧化碳,设样品溶液中碳酸钠和氢氧化钠物质的量分别为x、y,则x+y= c mol·L-1×V1 ×10-3L,2x+y= c mol·L-1×V2 ×10-3L,解得x= (c V2 ×10-3- c V1 ×10-3)mol,y=(2c V1 ×10-3- c V2 ×10-3)mol,碳酸钠和氢氧化钠物质的量浓度之比=物质的量之比=![]() ,若步骤⑥中滴定结束时仰视读数,导致消耗的盐酸体积偏大,即V2偏大,则x=(c V2 ×10-3- c V1 ×10-3)mol偏大,所得c(Na2CO3)偏大,故答案为:
,若步骤⑥中滴定结束时仰视读数,导致消耗的盐酸体积偏大,即V2偏大,则x=(c V2 ×10-3- c V1 ×10-3)mol偏大,所得c(Na2CO3)偏大,故答案为: ![]() ;偏大。
;偏大。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧衍生物⑤乙醇有刺激性气味
A.①③B.②③C.②④⑤D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2NA
B. 2.0gD2O中含有的质子数、电子数均为NA
C. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目一定为3NA
D. 14g分子式为CnH2n的烃中含有的共价键的数目一定为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
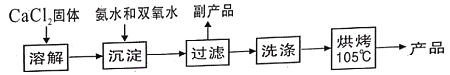
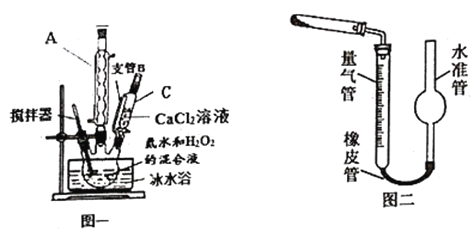
已知:CaO2的制备原理:CaCl2+H2O2+2NH3H2O+6H2O= CaO28H2O↓+2NH4Cl
请回答下列问题:
(1)仪器C的名称为__________,支管B的作用____________;
(2)加入氨水的作用是_______;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用_______;
A.水 B.浓盐酸 C.无水乙醇 D.CaCl2溶液
(4)沉淀反应时常用冰水浴控制温度在O℃左右,其可能原因是_________、_______(写出两种)。
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:________________;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中将盛有甲烷与氯气的混合气体的量筒倒立在盛有饱和食盐水的水槽中,光照使其发生反应,下列说法错误的是( )
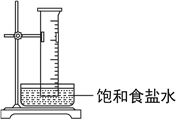
A. 通过量筒内壁上出现的油状液滴可以说明生成四种有机产物
B. 氯化氢极易溶于水,导致量筒中液面上升
C. 饱和食盐水能够抑制氯气的溶解
D. 量筒中气体颜色逐渐变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有四种物质:①氧化铁 ②硫酸 ③碳酸氢钠 ④氢氧化钠
a.找出属于盐的物质,写出其在水溶液中的电离方程式__________。
b.上述物质中有一种与其他三种物质均能反应,此物质是_________(填序号)。
c.写出铝与稀硫酸反应的离子方程式,并用双线桥标出电子转移情况________。
(2)有以下几种物质:①HCl气体,②硝酸钾溶液,③铜,④二氧化碳,⑤金刚石,⑥硫酸氢钠固体,⑦蔗糖,⑧NaCl晶体,⑨氨水,⑩熔融KCl。
以上能导电的是___________________(填序号,下同);
以上属于电解质的是_________________;属于非电解质的是__________________;
(3)写出工业上制备漂白粉的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
① 含有大量AlO2-的溶液中,NH4+、NO3-、H+、Cl-可以大量共存
② 0.1 molL-1的AlCl3溶液中,Na+、K+、SO42-、HCO3-可以大量共存
③ 向AlCl3溶液中加入过量的稀氨水,发生反应:Al3++4NH3H2O=AlO2-+4NH4++2H2O
④ 加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、NO3-一定能够大量共存
⑤ 用NaOH溶液除去铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
⑥ 依据铝热反应原理,能发生反应2Al+3MgO![]() 3Mg+Al2O3
3Mg+Al2O3
⑦ 向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO42-+2Ba2++Al3++4OH-=2BaSO4↓+AlO2-+2H2O
⑧ 常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A. ⑤⑦ B. ②③⑤ C. ④⑤⑥ D. ②⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com