
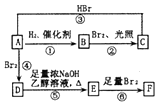
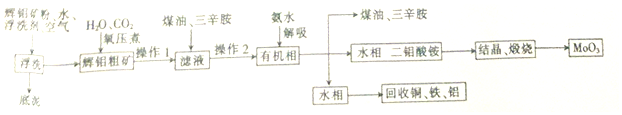
 烯烃A在一定条件下可以按下而的流程进行反应.
烯烃A在一定条件下可以按下而的流程进行反应.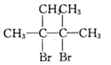
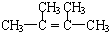 .
.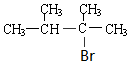 .
.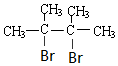 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$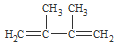 +2NaBr+2H2O.
+2NaBr+2H2O.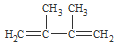 +2Br2→
+2Br2→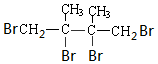 .
. 分析 由D的结构简式可推知A为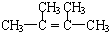 ,A与氢气发生加成反应生成B为
,A与氢气发生加成反应生成B为 ,A与HBr发生加成反应生成C,B与溴发生取代反应也生成C,故C为
,A与HBr发生加成反应生成C,B与溴发生取代反应也生成C,故C为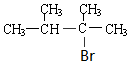 .D发生消去反应生成E为
.D发生消去反应生成E为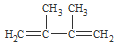 ,E与足量的溴发生加成反应生成F为
,E与足量的溴发生加成反应生成F为 .
.
解答 解:由D的结构简式可推知A为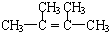 ,A与氢气发生加成反应生成B为
,A与氢气发生加成反应生成B为 ,A与HBr发生加成反应生成C,B与溴发生取代反应也生成C,故C为
,A与HBr发生加成反应生成C,B与溴发生取代反应也生成C,故C为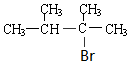 .D发生消去反应生成E为
.D发生消去反应生成E为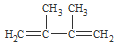 ,E与足量的溴发生加成反应生成F为
,E与足量的溴发生加成反应生成F为 .
.
(1)由上述分析可知,A的结构简式是: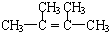 ,
,
故答案为: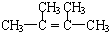 ;
;
(2)①③④⑥属于加成反应,②属于取代反应,⑤属于消去反应,
故答案为:②;
(3)由上述分析可知,C的结构简式是: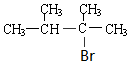 ,
,
故答案为: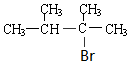 ;
;
(4)由D→E的化学方程式: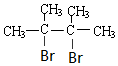 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$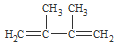 +2NaBr+2H2O,
+2NaBr+2H2O,
由 E→F的化学方程式: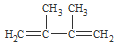 +2Br2→
+2Br2→ ,
,
故答案为: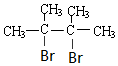 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$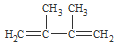 +2NaBr+2H2O;
+2NaBr+2H2O;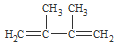 +2Br2→
+2Br2→ .
.
点评 本题考查有机物的推断,利用D的结构简式与反应条件进行解答,熟练掌握官能团的性质与转化,题目基础性,难度不大.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | X的液态单质可在医疗上用于冷冻麻醉 | |
| B. | Y、M两元素气态氢化物的稳定性:Y<M | |
| C. | 工业上制备Z的单质可电解其熔融态的氧化物 | |
| D. | 氧化物XO2与MO2均具有漂白性,且漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
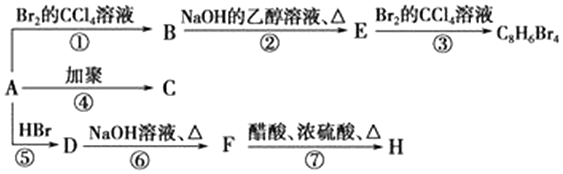
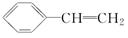 .
.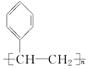 ,D
,D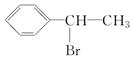 ,E
,E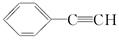 ,H
,H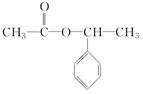 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.写出⑦反应的化学方程式
+NaBr.写出⑦反应的化学方程式 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$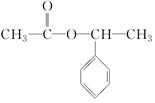 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
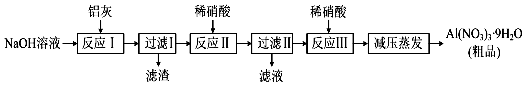
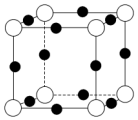 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题: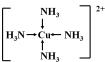 (用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.
(用箭头表示出提供孤对电子的原子).将 F 单质的粉末加入A的气态氢化物的水化物浓溶液中,通入 O2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
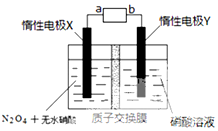 汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com