
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 1-氯丙烷和2-氯丙烷的消去产物相同 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| D. | 除去苯中苯酚,加入溴水后过滤 |
分析 A、煤的干馏是化学变化;
B、卤代烃的消去反应脱去的是卤素原子和卤素原子所在碳原子的相邻碳原子上的一个H原子;
C、互为同分异构体的有机物,支链越多熔沸点越低;
D、溴苯仍能溶于苯.
解答 解:A、煤的干馏是将煤隔绝空气加强热使其分解的过程,有新物质生成,故为化学变化,故A错误;
B、卤代烃的消去反应脱去的是卤素原子和卤素原子所在碳原子的相邻碳原子上的一个H原子,故1-氯丙烷和2-氯丙烷的消去产物均为丙烯,故B正确;
C、互为同分异构体的有机物,支链越多熔沸点越低,故正戊烷、异戊烷和新戊烷的沸点逐渐降低,故C错误;
D、苯酚和溴水反应后生成的溴苯仍能溶于苯,故除去苯中的苯酚不能加溴水,应加氢氧化钠溶液,故D错误.
故选B.
点评 本题考查了煤和石油的综合利用以及消去反应的反应机理和有机除杂问题,难度不大,应注意的是苯中的苯酚应加入氢氧化钠溶液来除去.


科目:高中化学 来源: 题型:解答题
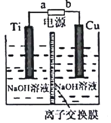
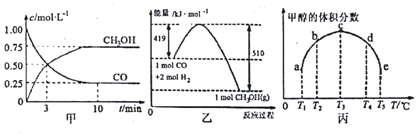
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NH4Cl溶液中含NH4+的数目小于0.01NA | |
| B. | 该反应释放H2的分子数为$\frac{V}{22.4}$NA | |
| C. | 反应中每消耗2molH+转移的电子数为6NA | |
| D. | 120.5gNCl3中所含共价键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂 | |
| B. | ClO2具有还原性,可用于自来水的杀菌消毒 | |
| C. | SiO2硬度大,可用于制造光导纤维 | |
| D. | NH3易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓度均为0.1 mol•L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 | |
| B. | 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 | |
| C. | 0.2 mol•L-1 HCOOH 与 0.1 mol•L-1 NaOH 等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) | |
| D. | 0.2 mol•L-1 CH3COONa 与 0.1 mol•L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH=CH2能发生取代反应,加成反应、氧化反应 | |
| B. | 月桂烯(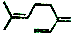 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲烷、乙烯、苯和乙醇都能使酸性KMnO4溶液褪色 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
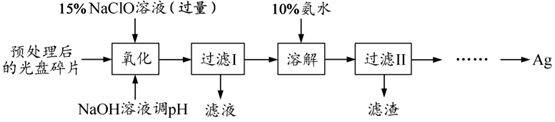
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
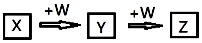 X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如图转化关系(其它产物已略去):下列说法不正确的是( )| A. | 若W是强氧化性的单质,则X可能是金属铝 | |
| B. | 若W是氢氧化钠,则X水溶液为酸性 | |
| C. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| D. | 若W是氧气,则X、Z的相对分子质量可能相差48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com