
分析 (1)根据CaCO3的Ksp计算该温度下饱和溶液中c(Ca2+),然后代入$\frac{S}{100g}=\frac{m(CaC{O}_{3})}{1000g}$计算溶解度S;
(2)根据离子方程式Ca2++CO32-=CaCO3↓计算剩余Ca2+的物质的量,然后代入c=$\frac{n}{V}$计算c(Ca2+),最后代入c(Ca2+)=$\frac{Ksp(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$计算.
解答 解:(1)饱和CaCO3溶液中CaCO3的浓度为c
CaCO3(s)?Ca2+(aq)+CO32-(aq)
c c c
Ksp(CaCO3)=c2=4.0×10-10 c=2.0×10-5
$\frac{S}{100g}=\frac{2.0×10{\;}^{-5}mol×100g/mol}{1000g}$
解得:S=2×10-5g,
答:该温度下CaCO3的溶解度约为S=2×10-5g;
(2)反应前n(Ca2+)=0.1mol/L×0.1L=0.01mol,n(CO32-)=0.3mol/L×0.1L=0.03mol,
Ca2++CO32-=CaCO3↓
0.01mol 0.03mol
反应后n(CO32-)=0.3 mol-0.1 mol=0.02mol,
c(CO32-)=$\frac{0.02mol}{0.1L+0.1L}$=0.1mol/L,
c(Ca2+)=$\frac{Ksp(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{4.0×10{\;}^{-10}}{0.1}$mol/L=1.0×10-9 mol/L,
答:完全反应后所得溶液中c(Ca2+)是1.0×10-9 mol/L.
点评 本题考查较为综合,涉及离子反应、溶度积常数、溶解度、离子浓度的综合计算,题目难度中等,平时学习中要特别重视计算能力的培养.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
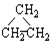 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.7 | C. | 0.75 | D. | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
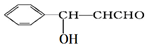 中含有的官能团为羟基,醛基.
中含有的官能团为羟基,醛基.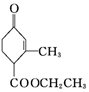 中含有的官能团名称是羰基(酮基),碳碳双键,酯基.
中含有的官能团名称是羰基(酮基),碳碳双键,酯基.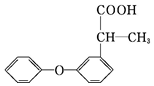 中的含氧官能团是醚键,羧基.
中的含氧官能团是醚键,羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g D2O中含有的质子数、中子数均为NA | |
| B. | 标准状况下,22.4 L CCl4含有NA个CCl4分子 | |
| C. | 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
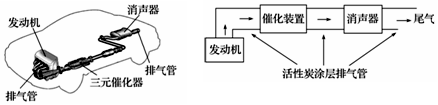
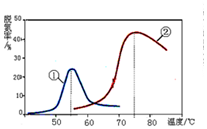
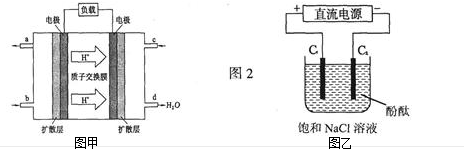
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向两份完全相同Ba(OH)2溶液中分别加入浓度相同的Al2(SO4)3和KAl(SO4)2,产生的沉淀的物质的量随所加溶液体积关系如图.下列分析不正确的是( )
向两份完全相同Ba(OH)2溶液中分别加入浓度相同的Al2(SO4)3和KAl(SO4)2,产生的沉淀的物质的量随所加溶液体积关系如图.下列分析不正确的是( )| A. | a、d两点的沉淀为BaSO4 | B. | b、c两点溶液的导电能力相同 | ||
| C. | b、c两点溶液的PH值相同 | D. | d点溶液中大量存在的阳离子是K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com