
| 0.42g |
| 84g/mol |
| 22400ml×0.01 |
| 1 |


科目:高中化学 来源: 题型:
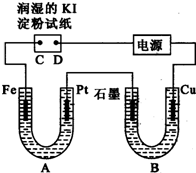 电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质 元素 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
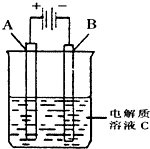 肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+=3Fe3++4H2O |
| C、用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
| D、CH3COOH溶液与NaOH溶液反应:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com