
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热为( )
O2(g)的反应热为( )
A.-191 kJ/molB.+191 kJ/molC.+244.15 kJ/molD.+488.3 kJ/mol
【答案】C
【解析】
根据燃烧热写出热化学方程式,再利用盖斯定律来计算反应![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热。
O2(g)的反应热。
25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1,
则H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1①,
O2(g)=H2O(l) △H=-285.8kJmol-1①,
C(s)+O2(g)=CO2(g) △H=-393.5kJmol-1②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJmol-1③,
由盖斯定律可知,-![]() (①×2+②×2-③)可得反应
(①×2+②×2-③)可得反应![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g),其反应热为:-
O2(g),其反应热为:-![]() ×[2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1]=+244.15kJ/mol。
×[2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1]=+244.15kJ/mol。
答案选C。


科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
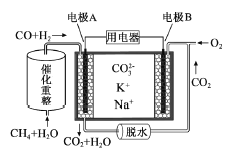
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸是用于合成治疗胃肠道痉挛及溃疡药物的中间体,其结构如图所示。下列有关说法正确的是
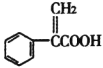
A.阿托酸分子中所有碳原子一定处于同一平面
B.阿托酸是含有两种官能团的芳香烃
C.阿托酸苯环上的二氯代物超过7种
D.一定条件下,1mol阿托酸最多能4mol H2、1mol Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,最近科学家研制出利用太阳能产生激光,在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
(1)太阳光分解海水时,实现了_____能转变为_______能,二氧化钛作_______。生成的氢气用于燃料电池时,实现了_______能转变为_______能。太阳光分解海水的反应属于_______(填“放热”或“吸热”)反应。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)请根据下列信息,写出H2燃烧热的热化学方程式________。
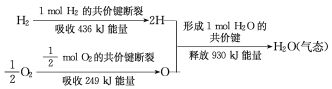
H2O(l) = H2O(g) ΔH = +44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰: 4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)Mn3+基态价层电子排布图为________。
(2)Mn(NO3)2·6H2O中非金属元素第一电离能从大到小的顺序__________。从电子云重叠的方式看N中存在的化学键类型有__________。
(3)与NO2-互为等电子体的一种分子的化学式为________。
(4)1molCH3COOH中含有的σ键数目为___________。CH3COOH分子通过氢键形成环状二聚物,写出含氢键表示的环状二聚物的结构简式___________。
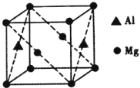
(5)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为_________。镁铝合金密度为ρg/cm3,则该晶胞的边长为__________nm(阿伏加德罗常数的值为N)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z的原子序数依次增大,且都不超过10.这四种元素可组成一种化合物的结构如图所示。下列说法正确的是( )
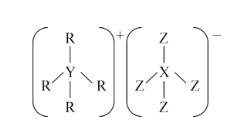
A.常温常压下,上述元素的单质都呈气态
B.最高价氧化物对应水化物的酸性:X>Y
C.Y、Z的气态氢化物能发生化合反应
D.由R、X两种元素只能形成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是____________________。
(2)滤液1中所含金属阳离子有_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程:
①升温到515℃时,Li2CO3开始分解产生CO2和碱性氧化物A,写出A的名称________,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_______________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B,固体B是______。
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案如下:边搅拌边向滤液1中加入_____________,再加入NaOH溶液调节pH范围为____________,过滤得到滤液2和滤渣,向滤渣中加入NaOH溶液pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2过滤、洗涤、低温烘干得Al(OH)3。
(5)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是__________,宜选用_____(“阳”或“阴”)离子交换膜。
②b中,生成Li2CO3反应的化学方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com