
【题目】高分子材料聚酯纤维H的一种合成路线如下:

已知:CH2=CHCH3![]() CH2=CHCH2Cl+HCl
CH2=CHCH2Cl+HCl
请回答下列问题:
(1)C的名称是____,D的结构简式为____。
(2)E—F的反应类型是____,E分子中官能团的名称是 ___。
(3)写出C和G反应生成H的化学方程式____。
(4)在G的同分异构体中,同时满足下列条件的结构有 ___种(不考虑立体异构)。
①属于芳香族化合物,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应
②1mol该有机物与3molNaOH恰好完全反应
③分子结构中不存在![]()
其中,核磁共振氢谱显示4组峰的结构简式为____。
(5)参照上述流程,以1-丁烯为原料合成HOCH2(CHOH)2CH2OH,设计合成路线____(无机试剂任选)。
【答案】乙二醇 ![]() 消去反应 碳碳双键、氯原子 nHOCH2CH2OH+n
消去反应 碳碳双键、氯原子 nHOCH2CH2OH+n![]()
![]()
![]() +(2n-1)H2O 13
+(2n-1)H2O 13 ![]() CH2=CHCH2CH3
CH2=CHCH2CH3![]() CH2=CHCHClCH3
CH2=CHCHClCH3![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() BrCH2CHBrCHBrCH2Br
BrCH2CHBrCHBrCH2Br![]() HOCH2CHOHCHOHCH2OH
HOCH2CHOHCHOHCH2OH
【解析】
相对分子质量为28的烯烃为乙烯,乙烯与溴加成生成B为CH2BrCH2Br,B在氢氧化钠水溶液中水解生成C为HOCH2CH2OH;C与G发生缩聚反应生成H,则H为![]() ;薄荷醇在浓硫酸、加热条件下发生羟基的消去反应,根据J逆推可知D为
;薄荷醇在浓硫酸、加热条件下发生羟基的消去反应,根据J逆推可知D为![]() ,D发生题目所给反应生成E,则E为
,D发生题目所给反应生成E,则E为![]() 。
。
(1)根据分析可知C为HOCH2CH2OH,其名称为乙二醇;D为![]() ;
;
(2)E为![]() ,在氢氧化钠醇溶液中发生消去反应生成F;E分子中官能团为氯原子和碳碳双键;
,在氢氧化钠醇溶液中发生消去反应生成F;E分子中官能团为氯原子和碳碳双键;
(3)乙二醇与对苯二甲酸发生缩聚反应生成H,方程式为nHOCH2CH2OH+n![]()
![]()
![]() +(2n-1)H2O;
+(2n-1)H2O;
(4)G的同分异构体满足:①属于芳香族化合物,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应,说明同时含有醛基、酯基、酚羟基;②1mol该有机物与3molNaOH恰好完全反应,说明酯基水解后可以生成酚羟基;③分子结构中不存在![]() ;则有以下几种情况:若苯环含有两个取代基,分别为-OH、-OOC-CHO,有3种;若苯环上有3个取代基,分别为-OH、-CHO、-OOCH,则有10种结构,共有13种同分异构体;其中核磁共振氢谱显示
;则有以下几种情况:若苯环含有两个取代基,分别为-OH、-OOC-CHO,有3种;若苯环上有3个取代基,分别为-OH、-CHO、-OOCH,则有10种结构,共有13种同分异构体;其中核磁共振氢谱显示![]() ;
;
(5)由目标产物可知需要在原料分子中先引入4个卤原子,之后再使卤原子水解生成羟基,再结合D到E的过程可知合成路线为:CH2=CHCH2CH3![]() CH2=CHCHClCH3
CH2=CHCHClCH3![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() BrCH2CHBrCHBrCH2Br
BrCH2CHBrCHBrCH2Br![]() HOCH2CHOHCHOHCH2OH。
HOCH2CHOHCHOHCH2OH。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含 CeFCO3)为原料制备 CeO2 的一种工艺流程如下:
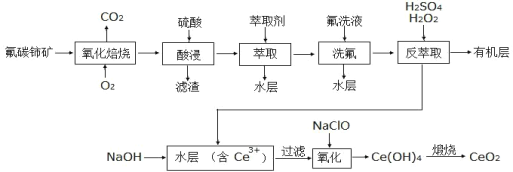
已知:①CeO2具有较强的氧化性,难溶于一般的酸或碱。
②F—能和很多金属离子形成较为稳定的配合物,如Ce4+能与 F—结合成CeF3+,Al3+也能与 F—结合成 AlF63-;它的这种性质有利于酸浸步骤,却不利于后续的沉淀步骤。
③Ce4+能被萃取剂 TBP 萃取,而 Ce3+不能。回答下列问题:
(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_____。
(2)氧化焙烧后的固体产物中含有 CeO2 和 CeF4 物质的量之比为 3:1,“酸浸”时发生反应的离子方程式为_____________。传统工艺中用盐酸替代硫酸,其缺点为________________。
(3)TBP是一种有机萃取剂,“萃取”时存在反应CeF3++TBP![]() CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
CeTBP4++F-,氟洗液中添加 Al3+的作用是________________。
(4)“反萃取”步骤中发生反应的离子方程式为________________。
(5)反萃取后的水层溶液中 c(Ce3+)=1mol/L,c(Al3+)= 0.01mol/L,应先加入 NaOH 溶液调节溶液的___<pH<_______ ,除去 Al3+后,再加入 NaOH 调节溶液的 pH 大于_____(保留一位小数),即可确保 Ce3+已完全沉淀。(已知:常温下,当溶液中的某离子浓度小于 1.0×10-5mol·L-1时,可认为该离子沉淀完全。Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21)。
(6)CeO2是汽车尾气净化催化剂的关键成分,在尾气消除过程中发生着 CeO2 与 CeO2(1-x) (0≤x≤0.25)的相互转化。写出 CeO2 消除 CO尾气的化学方程式:______________。
(7)CeO2(1-x)中的 Ce为+3、+4 价,测定 x的值可判断它们的比例。现取 CeO2(1-x)固体 0.8280 g,加入足量硫酸和 0.0110 molFeSO4·7H2O充分溶解,使 Ce4+全部被还原成 Ce3+,再用 0.1000 mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗 20.00 mL 标准溶液。(已知氧化性:Ce4+>KMnO4)
①x的值为_____。
②若加入的 FeSO4·7H2O 部分变质,会导致测定的 x 值_____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
A.新平衡后c(CH3OCH3)增大
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
(3)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
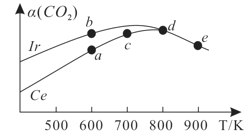
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(4)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式__________。该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小。
(5)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是________。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋(BiOCl)常用于电子设备等领域,BiOCl难溶于水,它是BiCl3的水解产物。以铋的废料(主要含铋的化合物,含少量铜、铅、锌的硫酸盐及Cu2S和Fe2O3等)为原料生产高纯度BiOCl的工艺流程如下:
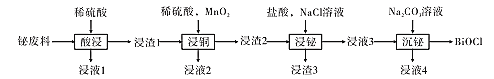
请回答下列问题:
(1)在浸液1中加入过量的锌,过滤,将滤液蒸发浓缩、降温结晶、过滤、洗涤、干燥得结晶水合物M,M的摩尔质量为287 g·mol-1,M为 ___(填化学式)。
(2)已知:浸液2呈蓝色,浸渣2含有少量硫单质。“浸铜”中MnO2的作用是____(用离子方程式表示)。
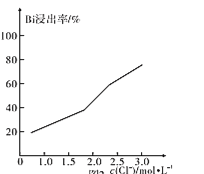
(3)“浸铋”中,铋的浸出率与温度关系如图所示:
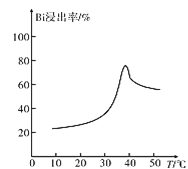
在高于40℃左右时“铋浸出率”开始下降,其主要因素可能是____(从两个角度分析)。
(4)在室温和液固比固定的条件下,c(HCl)=1.0mol·L-1时,铋的浸出率与溶液中c(Cl-)的关系如图所示。“浸铋”操作中,加入NaCl的目的是____。
(5)浸液3中主要溶质是BiCl3,“沉铋”过程中,有气体放出。“沉铋”的主要化学反应的方程式为____。从绿色化学角度看,浸液4可以用于____(填“酸浸”、“浸铜”或“浸铋”)。
(6)测定产品的纯度:取mg充分洗涤并干燥后的产品,溶于稍过量的浓硝酸中,加水稀释到100.0mL,取20.0mL于烧杯中,用cmol·L-1的AgNO3标准溶液滴定至终点(用Na2CrO4,作指示剂),消耗AgNO3标准溶液VmL,则产品中BiOCl的质量分数为____%(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大。
的原子序数依次增大。![]() 与
与![]() 同周期且相邻,
同周期且相邻,![]() 的基态原子的
的基态原子的![]() 电子数与
电子数与![]() 电子数相等,乙是地壳中含量最多的金属元素,
电子数相等,乙是地壳中含量最多的金属元素,![]() 的原子核外价电子排布式为
的原子核外价电子排布式为![]() ,
,![]() 的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:![]()
B.简单离子的半径:![]()
C.![]() 的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由![]() 、
、![]() 、
、![]() 三种元素形成的某种化合物可用于检查司机是否酒后驾车
三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示 π键,下列说法不正确的是( )
,其中椭圆框表示 π键,下列说法不正确的是( )
A.N2 分子与 CO 分子中都含有三键
B.CO 分子中有一个 π 键是配位键
C.N2 与 CO 互为等电子体
D.N2 与 CO 的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,英国化学家汉弗莱·戴维发现了N2O气体。在食品行业中,N2O可用作发泡 剂和密封剂。
(l) N2是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为________。
(2)N2O在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g)△H。
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) △H1=-1010KJ/mol
4NH3(g)+3O2(g) =2N2(g)+6H2O(l) △H2=-1531KJ/mol
△H=__________。
(3)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O
CO2(g)十N2(g)的能量变化及反应历程如下图所示,两步反应分别为:反应①Fe++N2O![]() FeO+N2;反应②______________
FeO+N2;反应②______________
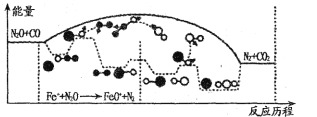
由图可知两步反应均为____(填“放热”或“吸热”)反应,由______(填“反应①或反应②”)决定反应达到平衡所用时间。
(4)在固定体积的密闭容器中,发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定N2O的平衡转化率。部分实验结果如图所示:
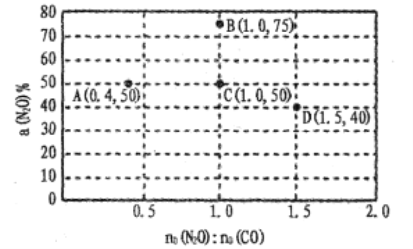
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是:____ ;
②图中C、D两点对应的实验温度分别为TC和TD,,通过计算判断TC____TD(填“>”“=”或“<”)。
(5)在某温度下,向1L密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)![]() CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
CO2(g)十N2(g),随着反应的进行,容器内CO的物质的量分数变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
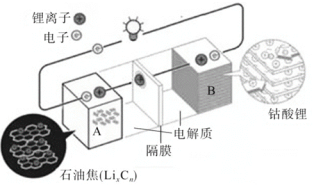
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,阳极反应为LiCoO2xe=Li(1-x)CoO2+xLi+
C.充电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种有机高分子,其合成路线如下:
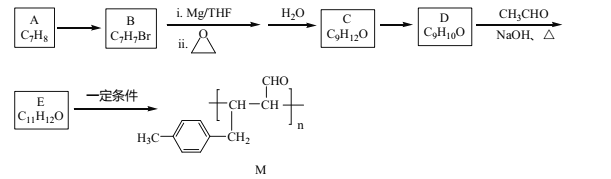
已知:①R-Br![]()
![]() R-CH2CH2OH
R-CH2CH2OH
②R-CHO![]() R-CH=CHCHO
R-CH=CHCHO
回答下列问题:
(1)A→B的反应试剂及条件是_______________。
(2)C→D的反应类型是_______________。
(3)化合物C的名称是_____________。
(4)D与银氨溶液反应的化学方程式为__________。
(5)E中官能团的名称是_______。
(6)化合物X(C10H10O)是E的同系物,且苯环上只有两个取代基,则X的同分异构体有______种,其中核磁共振氢谱为六组峰,峰面积之比为3:2:2:1:1:1的结构简式为________。
(7)设计由CH3Cl、环氧乙烷和乙醛制备CH3CH2CH=CHCHO的合成路线________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com