
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有 ( )
A.14种 B.8种 C.18种 D.16种
【知识点】同分异构体
【答案解析】D 解析:有机物甲的分子式应为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,则有机物甲为酯.由于同质量的乙和丙的蒸气所占体积相同,说明乙和丙的相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH,含有5个C原子的醇的有8种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH2CH2CH(OH)CH3,CH3CH2CH(OH)CH2CH3;CH3CH2CH(CH3)CH2OH,CH3CH2C(OH)(CH3)CH3,CH3CH(OH)CH(CH3)CH3,CH2(OH)CH2CH(CH3)CH3;
CH3C(CH3)2CH2OH,所以有机物甲的同分异构体数目有2×8=16 ,故D正确;
故答案选D
【思路点拨】本题考查同分异构体的书写,根据已知条件判断醇和酸是本题的关键,难度适中。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
下表是元素周期表的短周期部分,表中字母分别表示一种元素。
| a | |||||||
| d | f | g | |||||
| b | c | e | h |
请回答下列问题:
(1)g与a可形成化合物a2g,试写出它的结构式 。
(2)d、f、h 三种元素最高价氧化物对应的水化物的酸性由弱到强的顺序为(用化学式表示) 。
(3)在1L的密闭容器中,通入1mol f2气体和3mol a2气体,一定温度下反应生成fa3气体,2 min时,测得f2的浓度为0.75mol·L-1,则2 min时fa3的物质的量为 mol ,a2的平均反应速率v(a2)= mol·(L·min) -1。
(4)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物乙醇,该反应的化学方程式为: 。
(5)1g甲烷完全燃烧生成液态水,放出56kJ的热量,请写出热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的组合是 ( )
①用溴水除去混在苯中的己烯,分液得到纯净的苯
②将电石与水反应产生的乙炔通入溴水中,溴水褪色,证明乙炔和溴水发生了加成反应
③将溴乙烷和NaOH乙醇溶液混合共热,生成的气体直接通入酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明有乙烯生成
④用淀粉碘化钾试纸和白醋溶液可以检验加碘盐中的碘元素
⑤油脂在NaOH稀溶液中发生水解反应后,若静置不分层,说明水解完全
⑥丙氨酸中有手性碳原子
A.①②③ B.④⑤⑥ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.生活中用食盐水制取消毒液应用的是电解原理
B.自然界中无游离态的钠、钾、硅,有游离态的铁、硫、氧
C.合金属于金属材料,陶瓷属于非金属材料,化纤属于有机高分子材料
D.泡沫灭火器中用硫酸铝与饱和小苏打溶液反应,与盐类的水解知识无关
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)电镀是将镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。
(3)酸浸法制取硫酸铜的流程示意图如下:

①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为 。
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1molMnO2转移2 mol电子,该反应的离子方程式为:
。
④步骤(iv)除去杂质的化学方程式可表示为
3Fe3++NH4++2SO42-+6H2O=NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,
c( )=a mol·L—1,c(
)=a mol·L—1,c( )=b mol·L—1,c(
)=b mol·L—1,c( )=d mol·L—1,
)=d mol·L—1,
该反应的平衡常数K= (用含a、b、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,W的+1价阳离子正好充满K,L,M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、W几种元素中第一电离能最小的是___________ (填元素符号),D元素的原子核外有
种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物ECAB中的阴离子与AC2互为等电子体,该阴离子的电子式是 。
 (4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
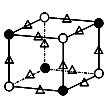
 (5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的
 (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)W的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配
离子如右图所示,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
现有0.2mol/L Ba(NO3)2溶液,则2L该溶液中含有________mol Ba2+;3L该溶
液中含有________mol NO3-;0.5L该溶液中NO3-的物质的量浓度为________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com