
下列是关于氯水的叙述,正确的是
A.新制氯水中只含Cl2和HClO分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡冒出,该气体为Cl2
D.氯水放置数天后,pH值将增大
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W原子序数依次增大,X 与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
A.微粒半径:X<X
B.简单氢化物的稳定性:Z比W的强
C.W的氧化物的水化物的酸性一定比Z的强
D.最外层电子数由大到小的顺序为:Z、W、Y
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列陈述I、II均正确且有因果关系的是
陈述I | 陈述II | |
1 | 常温下铁与浓硫酸不反应 | 可用铁槽车密封运送浓硫酸 |
2 | NaHCO3溶于水完全电离 | NaHCO3是强电解质 |
3 | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
4 | H2O2、SO2能使酸性KMnO4溶液褪色 | H2O2表现还原性,SO2表现漂白性 |
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
250 ℃和1.01×105 Pa时,反应2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期期中测试理综化学试卷(解析版) 题型:推断题
下图是一种常见的氨基酸G的合成路线:

已知以下信息:
①A苯环上只有1个取代基,核磁共振氢谱有6组峰,且峰面积比为1:2:2:2:2:1;
②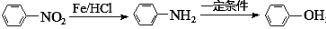 ;
;
③F、G均能与FeCl3溶液发生显色反应,F苯环上的一氯代物只有两种;
④
回答下列问题:
(1)A的分子式为 ,A的名称为 ________。
(2)C→D的反应类型是 ,G的结构简式为 __________。
(3)鉴别F和G可用的试剂是 ______。
A.Na B.NaOH
C.Na2CO3 D.NaHCO3
E.FeCl3
(4)A→B的化学方程式为 __________,该反应的目的是 ___。
(5)F的同分异构体中,含有苯环且能发生水解反应的异构体有 种,其中核磁共振氢谱有4组峰,且面积比为3∶2∶2∶1的是 ___________________。
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:选择题
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,不一定能产生沉淀的是
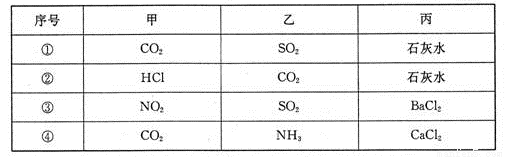
A.②④ B.① C.①③ D.④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上期中测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
B.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
C.碳酸钙与盐酸反应: CO32-+2H+=CO2↑+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016届福建省晨曦、冷曦、正曦、岐滨四校高三第二次联考理综化学试卷(解析版) 题型:填空题
(16分)氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g)  2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)  N2O2(g) ΔH1<0 ②__________________________
N2O2(g) ΔH1<0 ②__________________________
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g)  2NO2(g) ΔH______0(填“<”或 “>”);
2NO2(g) ΔH______0(填“<”或 “>”);
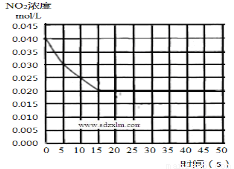
(3)2NO(g) + O2(g)  2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)
2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com