
| A. | 4:3:2 | B. | 1:2:1 | C. | 2:1:1 | D. | 1:1:1 |
分析 方法1、Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,由混合气体的体积可得出氢气、氧气的物质的量.氢气来源于钠和水的反应,通过氢气可求出钠的物质的量;氧气来源于过氧化钠与水的反应,通过氧气的物质的量可求出过氧化钠的物质的量.物质的量乘以摩尔质量可分别求出钠、过氧化钠的质量,总重量减去钠、过氧化钠的质量就是氧化钠的质量,质量除以摩尔质量可得氧化钠的物质的量,用钠、氧化钠、过氧化钠的物质的量之比即可.(针对计算题)
方法2、Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,直接核对选项即可得答案(针对选择题).
解答 解:Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,直接核对选项即可得答案.(针对选择题)
钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑ 钠与氢气的关系式为2Na--H2
2Na2O2+2H2O=4NaOH+O2↑ 过氧化钠与氧气的关系式为 2Na2O2--O2
2H2+O2$\frac{\underline{\;放电\;}}{\;}$2H2O 氢气和氧气的关系式为2H2--O2
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,
通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na--2H2--O2--2Na2O2
所以钠与过氧化钠的物质的量之比为4:2,满足条件的为AC,
故选AC.
点评 本题考查混合物反应的计算,题目难度中等,如果采用常规做法,计算量较大,应用公式次数较多,较容易出错,如果抓住关键字采用关系式进行分析m化繁为简,效果较好.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 | |
| B. | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | |
| C. | 向50mL12mol•L-1的浓硝酸中加入足量铜片其充分反应,生成0.3molNO2 | |
| D. | 运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
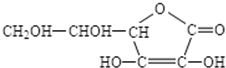
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
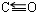 ;写出另一与CO互为等电子体的化学式CN-.
;写出另一与CO互为等电子体的化学式CN-.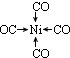 ;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.
;写出基态Ni原子的电子排布式1s22s22p63s23p63d84s2.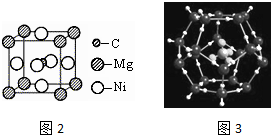
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
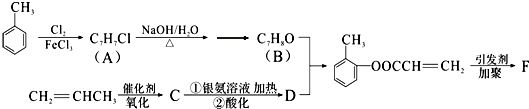
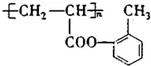
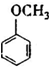 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量的氢氧化钠残留在烧杯中 | |
| D. | 用带游码的托盘天平称2.4g氢氧化钠时误用了“左码右物”的操作 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com