
| A. | NaOH | B. | CuSO4 | C. | HCl | D. | NaCl |
科目:高中化学 来源: 题型:选择题
| A. | HNO3是挥发性一元酸 | |
| B. | Al2O3是金属氧化物、也是碱性氧化物 | |
| C. | 氧气和臭氧的相互转化是物理变化 | |
| D. | 利用过滤法可把Fe(OH)3胶体从FeCl3溶液中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+HNO3(浓)--Zn(NO3)2+NO2↑+H2O | B. | Zn+HNO3(浓)--Zn(NO3)2+NO↑+H2O | ||
| C. | Zn+HNO3(很稀)--Zn(NO3)2+NO2↑+H2O | D. | Zn+HNO3(很稀)--Zn(NO3)2+NH4NO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 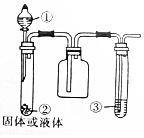 |
| A | 浓氨水 | 生石灰 | 石蕊试液 | 氨气是碱性气体 | |
| B | 浓硝酸 | 铜片 | 淀粉-KI溶液 | NO2水溶液具有氧化性 | |
| C | 浓硫酸 | 亚硫酸钠 | 酸性高锰酸钾溶液 | SO2具有漂白性 | |
| D | 浓盐酸 | 二氧化锰 | 紫色石蕊试液 | 氯气具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
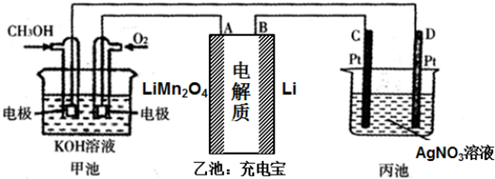
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
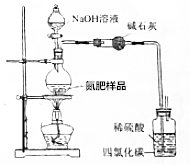 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com