碳化硅(SiC)、氧化铝(Al
2O
3) 和氮化硅(Si
3N
4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
(1)Al的原子结构示意图为
;Al与NaOH溶液反应的离子方程式为
.
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为
.
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl
4(g)+2N
2(g)+6H
2(g)
Si
3N
4(s)+12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl
4(g)、0.2mol N
2(g)、0.6mol H
2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si
3N
4(s)的质量是5.60g.
①H
2的平均反应速率是
mol/(L?min).
②平衡时容器内N
2的浓度是
mol?L
-1.
③SiCl
4(g)的转化率是
.
④若按n(SiCl
4):n(N
2):n(H
2)=3:2:6的投料配比,向上述容器不断扩大加料,SiCl
4(g)的转化率应
(填“增大”、“减”或“不变”).
⑤工业上制备纯硅反应的热化学方程式如下:
SiCl
4(g)+2H
2(g)═Si(s)+4HCl(g);△H=+QkJ?mol
-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl
4的转化率
B.若反应开始时SiCl
4为1mol,则达到平衡时,吸收热量为QkJ
C.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol?L
-1的NaOH恰好反应
D.反应至4min时,若HCl的浓度为0.12mol?L
-1,则H
2的反应速率为0.03mol/(L?min)

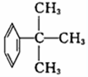
 ②
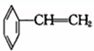
② ③
③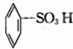 ④
④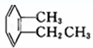 ⑤
⑤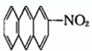
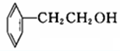 ⑦
⑦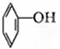 ⑧CH3CH=CH-COOH⑨
⑧CH3CH=CH-COOH⑨