
【题目】从某矿渣(成分为NiFe2O4、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
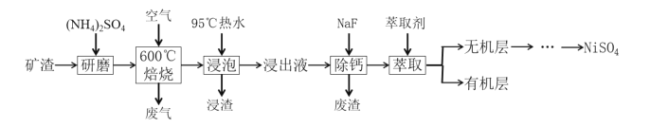
已知①600℃时发生反应:NiFe2O4+4H2SO4═NiSO4+Fe2(SO4)3+4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将NiFe2O4写成氧化物的形式为__;(NH4)2SO4的作用是__。
(2)“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为__。
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有__(写化学式)。
(4)向“浸出液”中加入NaF以除去Ca2+,当溶液中c(F-)=2.0×10-3molL-1时,若除钙率为99%,则原“浸出液”中c(Ca2+)=__gL-1。
(5)“萃取”后,分离得到无机层的操作为__,用到的主要玻璃仪器是__。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4是倍受关注的一类新型、高效、无毒的多功能水处理剂。回答下列问题:
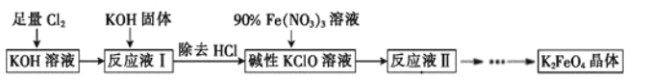
①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为__。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是__。
【答案】NiOFe2O3 提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等) 4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O SiO2 4.0×10-2 分液 分液漏斗 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2 高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液
2Fe2(SO4)3+6H2O SiO2 4.0×10-2 分液 分液漏斗 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2 高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4.NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用;
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)(NH4)2SO4的作用:提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等),故答案为:NiOFe2O3;提供和矿渣反应的硫酸(或硫酸铵分解产生硫酸等);
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O,故答案为:4FeO+6H2SO4+O2
2Fe2(SO4)3+6H2O,故答案为:4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O;
2Fe2(SO4)3+6H2O;
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有SiO2,故答案为:SiO2;
(4)当溶液中c(F-)=2.0×10-3molL-1时,c(Ca2+)=![]() molL-1=1.0×10-5molL-1,原“浸出液”中c(Ca2+)为x,除钙率为
molL-1=1.0×10-5molL-1,原“浸出液”中c(Ca2+)为x,除钙率为![]() ×100%=99%,x=1.0×10-3mol/L=(1.0×10-3mol×40g/mol)/L=4.0×10-2gL-1
×100%=99%,x=1.0×10-3mol/L=(1.0×10-3mol×40g/mol)/L=4.0×10-2gL-1
故答案为:4.0×10-2;
(5)“萃取”后,分离得到无机层的操作是分液,主要仪器是分液漏斗,故答案为:分液;分液漏斗;
(6)①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
②足量的氯气与KOH反应得到“反应液I”,“反应液I”中含有过量的氯气,在“反应液I”中加KOH固体可以与“反应液I”中过量的Cl2继续反应,生成更多的KClO,反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是:高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液,故答案为:高铁酸根在苛性钠溶液中的溶解度大于苛性钾溶液。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
A. 配制FeCl3溶液
配制FeCl3溶液
B.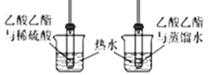 酯水解程度比较
酯水解程度比较
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D.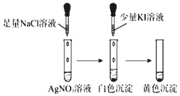 卤化银沉淀的转化
卤化银沉淀的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
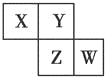
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。下列说法错误的是
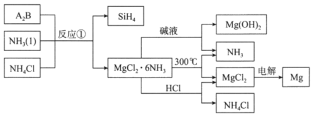
A.A2B的化学式为Mg2Si
B.该流程中可以循环使用的物质是NH3和NH4Cl
C.利用MgCl2·6NH3制取镁的过程中发生了化合反应、分解反应
D.分别将MgCl2溶液和Mg(OH)2悬浊液加热、灼烧,最终得到的固体相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
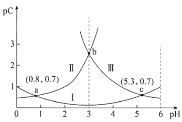
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储量丰富成本低的新型电池系统引起了科学家的广泛关注。基于K+能够可逆地嵌入/脱嵌石墨电极,开发了基于钾离子电解液(KPF6)的新型双碳电池[碳微球(C)为正极材料,膨胀石墨(C*y)为负极材料],放电时总反应为:KxC*y+xC(PF6)=C*y+xK++xC+xPF6-,如图所示。下列叙述错误的是( )
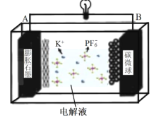
A.放电时,K+在电解质中由A极向B极迁移并嵌入碳微球中
B.充电时,A极的电极反应式为C*y+xK++xe-=KxC*y
C.放电时,每转移0.1NA电子时,电解质增重18.4g
D.充放电过程中,PF6-在碳微球电极上可逆地嵌入/脱嵌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液、医用酒精等能对新冠病毒进行有效消杀。某兴趣小组在实验室自制“84”消毒液。请回答以下问题:
(1)“84”消毒液消杀新冠病毒的原理是__。
(2)甲同学设计图1所示实验装置(夹持装置省略)制取“84”消毒液。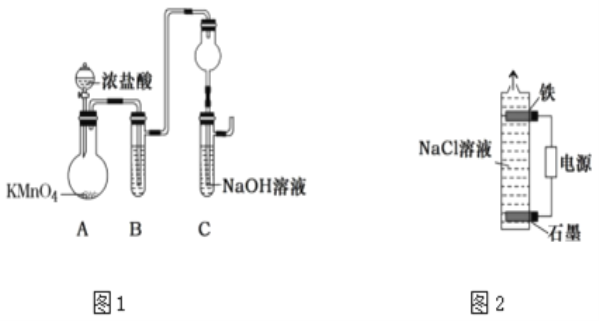
①B中的试剂是__。
②干燥管的作用是__。
③当C中NaOH溶液吸收完全后,停止通氯气,检验氯气已过量的方法为__。
(3)乙同学设计图2所示电解装置制取“84”消毒液。
①铁电极作__极。
②该电解制取NaClO的总反应的化学方程式为__。
③充分电解后,为检验电解液中是否还残留少量Cl-,取少量电解后溶液于试管中,滴加AgNO3溶液,试管中产生白色沉淀并有无色气体产生,该气体能使带火星的木条复燃。试管中发生反应的离子方程式为___。
④取25.00mL电解后溶液,加入过量KI与稀硫酸混合溶液,充分反应后加入2滴淀粉液,用0.1000molL-1Na2S2O3溶液滴定,消耗12.00mL。则该电解液有效氯(以有效氯元素的质量计算)的浓度为___mg/L。(已知:2S2O32-+I2═S4O62-+2I-)
(4)与甲同学制法相比,乙同学制法的优点除了有装置与操作简单外还有:__、__(请列举出两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
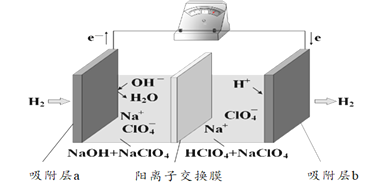
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O
C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1NaHC2O4溶液中缓慢滴加pH=13的NaOH溶液,混合溶液的温度与滴加NaOH溶液体积的关系如图所示。下列说法错误的是( )
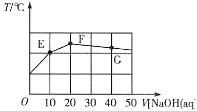
A.E点存在:2c(Na+)=3c(H2C2O4)+3c(HC2O4-)+3c(C2O42-)
B.F点存在:c(OH-)>c(H+)+c(HC2O4-)+c(H2C2O4)
C.在E、F和G点中,G点对应的Kw最小
D.G点对应的溶液中,c(Na+)>c(OH-)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com