
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.影响分子晶体的熔沸点高低的因素为分子间作用力;
B.分解发生化学变化,不仅仅与晶格能大小有关;
C.离子晶体中,阳离子与阴离子的半径比越大,配位数越大;
D.晶格能越大,越易先析出.
解答 解:A.键能影响稳定性,影响分子晶体的熔沸点高低的因素为分子间作用力,故A错误;
B.分解发生化学变化,不仅仅与晶格能大小有关,碳酸镁低于碳酸钡,故B错误;
C.离子晶体中,阳离子与阴离子的半径比越大,配位数越大,NaCl的配位数为6,而CsCl的配位数为8,故C正确;
D.晶格能越大,熔点越高,则越易先析出,故D错误.
故选C.
点评 本题考查元素周期律知识以及键能、晶体等知识,为高频考点,注意把握元素周期律的递变规律,把握元素的性质与对应单质、化合物的性质的递变规律以及比较的角度,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:填空题
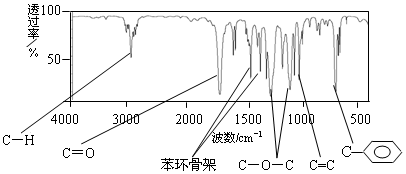
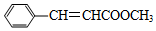 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Na+ | 10560 | Cl- | 18980 |
| Mg2+ | 1272 | Br- | 64 |
| Ca2+ | 400 | SO42- | 2560 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.
如图所示的过程是目前直接利用太阳能的研究热点.人们把通过人工光化学手段合成燃料的过程叫做人工光合作用.| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.
液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸在酯化反应中只起催化剂作用 | |
| B. | 酯化反应是有限度的 | |
| C. | 酯化反应的机理是酸去羟基,醇去羟基上的氢原子 | |
| D. | 酯化反应也属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素之间只能形成共价化合物 | |
| B. | 第IA族元素的金属性一定比IIA族元素的金属性强 | |
| C. | 短周期中,同周期元素的离子半径从左到右逐渐减小 | |
| D. | 非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com