
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧 | 火焰呈黄色 | 待测液不含钾元素 |
| B | AgBr沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgBr更难溶 |
| C | 铁丝插入稀硝酸中 | 有无色气体产生 | 生成氢气 |
| D | 向NaCN溶液中滴加无色酚酞试液 | 溶液变红 | HCN是弱电解质 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
查看答案和解析>>
科目:高中化学 来源: 题型:
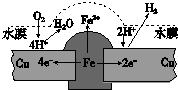 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、服用铬含量超标的药用胶囊会对人对健康造成危害 |
| B、食用一定量的油脂能促进人体对某些维生素的吸收 |
| C、CH4和Cl2在光照条件下反应的产物最多可能有四种 |
| D、无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体 析出 |
蛋白质均发生变性 |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色 沉淀 |
溶液X中不一定含有SO42- |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色 沉淀 |
H2SiO3的酸性比H2CO3的酸性强 |
| D | 向浓度均为0.1mol?L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色 沉淀 |
Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:| A、该温度下此反应平衡常数为3.2 | ||
| B、A的初始物质的量为4 mol | ||
| C、0-15min内,气体密度不变 | ||
D、要使
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用植物油的加成反应可以制得人造黄油 |
| B、75%的酒精可使蛋白质变性从而起到消毒作用 |
| C、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
D、可用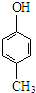 和HCHO为原料合成 和HCHO为原料合成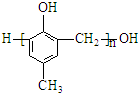 |
查看答案和解析>>
科目:高中化学 来源: 题型:
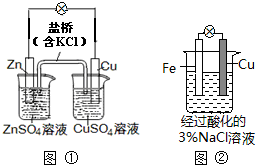
| A、图①中正极附近溶液pH降低 |
| B、图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、图②正极反应是O2+2H2O+4e-═4OH- |
| D、图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
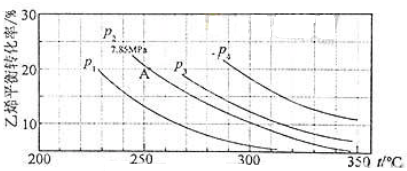
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com