
科目:高中化学 来源: 题型:阅读理解
 AgOH+H+
AgOH+H+ AgOH+H+
AgOH+H+
| ||
| ||

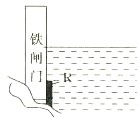
 门上的固体材料R可以采用
门上的固体材料R可以采用 方向为
方向为查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门六中高二上学期期中考试化学试卷 题型:填空题
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极: ;负极: 。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用 。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的 极。
查看答案和解析>>
科目:高中化学 来源:2013届山东省高二下学期阶段性测试化学试卷(解析版) 题型:选择题
为了降低某水库的铁闸门被腐蚀的速率,可以采取如图所示的方案,其中焊接在铁闸门上的固体材料R可以采用

A.铜 B.钠 C.锌 D.石墨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com