
 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1, (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)分析 (1)反应为吸热反应,物质能量越高越活泼,能量越低越稳定;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧放热,放热反应的焓变为负值比较大小,据此分析判断;
(3)1molBr2参与反应时释放出125KJ热量,则反应2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)会放出250KJ的能量,根据热化学方程式的含义和书写方法来回答;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为$\frac{1440KJ}{12}$=120kJ;
(5)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280.0kJ•mol-1
③C(石墨)+O2(g)=CO2(g)△H=-390.5kJ•mol-1
依据盖斯定律计算,①+②×3-③×3得到2Fe2O3(s)=4Fe(s)+3O2(g) 反应的焓变.
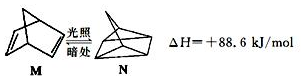
解答 解:(1) ,反应为吸热反应,M能量低于N,则M能量低稳定,
,反应为吸热反应,M能量低于N,则M能量低稳定,
故答案为:M转化为N为吸热反应,能量升高,M能量低,稳定些;
(2)已知 (l)的燃烧热为3267.5kJ•mol-1,
(l)的燃烧热为3267.5kJ•mol-1, (l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ•mol-1,
(l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3267.5kJ•mol-1, (l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJ•mol-1,氢气燃烧放热,放热反应的焓变为负值,则a>-3267.5kJ•mol-1 ,
(l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJ•mol-1,氢气燃烧放热,放热反应的焓变为负值,则a>-3267.5kJ•mol-1 ,
故答案为:>;
(3)1molBr2参与反应时释放出125kJ热量,则反应2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)会放出250KJ的能量,即2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=-250kJ•mol-1,
故答案为:2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=-250kJ•mol-1;
(4)将C(石墨)、Al粉和TiO2固体在一定比例的条件下,在极高的温度下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1440kJ•mol-1,所给反应中转移12个电子,故每转移1mol电子放出的热量为$\frac{1440KJ}{12}$=120kJ,则反应过程中,每转移amol电子放出的热量为120a kJ,
故答案为:120a kJ;
(5)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280.0kJ•mol-1
③C(石墨)+O2(g)=CO2(g)△H=-390.5kJ•mol-1
依据盖斯定律计算,(①+②×3-③×3)×2得到:2Fe2O3(s)=4Fe(s)+3O2(g)△H=+1643.0 kJ•mol-1 ,
故答案为:+1643.0 kJ•mol-1.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断、热化学方程式计算、氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液混合,AgCl和AgI都沉淀 | |
| B. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| C. | 向AgI的饱和溶液中加AgNO3,c(Ag+)增大,Ksp(AgI)也增大 | |
| D. | 若取0.1435克AgCl固体配成100mL溶液,c(Cl-)为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/kJ•mol-1 | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
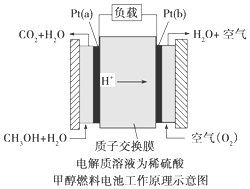
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 电池的总反应是 2C4H10+13O2=8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为 O2+4e-=2O2- | |
| D. | 通入丁烷的一极是负极,电极反应为 C4H10+13O2-+26e-=4CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡常数减小 | |
| B. | 平衡逆向移动,氧气的物质的量浓度减小 | |
| C. | 体系的压强不变 | |
| D. | BaO2的量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=3 mol•L-1•min-1 | B. | v(B)=6 mol•L-1•min-1 | ||
| C. | v(C)=2.5 mol•L-1•min-1 | D. | v(D)=4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com