
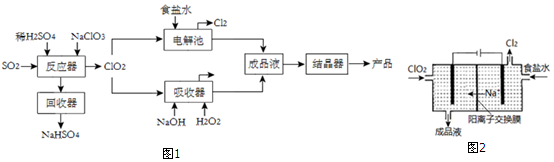
 25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )
25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=14的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )| A. | HA溶液的物质的量浓度为0.0l mol/L | |
| B. | a→b的过程中,混合溶液不可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-6 |
分析 A.恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠0.04mol,计算氢氧化钠物质的量和酸物质的量相同计算得出HA的浓度;
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,依据电荷守恒分析;
C.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应;
D.电离平衡常数K=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$计算得到判断.
解答 解:A.恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×1mol/L=0.04mol,得出50mlHA的浓度=$\frac{0.04mol}{0.05L}$=0.8mol/L,故A错误;
B.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+),故B错误;
C.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故C错误;
D.电离平衡常数K=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$=$\frac{0.001×0.001}{0.8}$=1.25×10-6,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析计算能力,知道酸碱混合过程中溶液温度变化原因及曲线变化及拐点含义,难点是电离平衡常数的计算.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧可生成多种氧化物,23 g钠充分燃烧时转移电子数为NA | |
| B. | 1 L 0.1 mol/L的NaHCO3溶液中HCO3-离子数为0.1 NA | |
| C. | 1L pH=1的稀硫酸中有0.2 NA个H+ | |
| D. | 标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
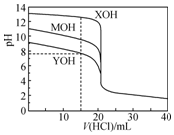 常温下用0.100 0mol•L-1的盐酸分别逐滴加入到20.00mL 0.100 0mol•L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示.下列说法正确的是( )
常温下用0.100 0mol•L-1的盐酸分别逐滴加入到20.00mL 0.100 0mol•L-1的三种一元碱MOH、XOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示.下列说法正确的是( )| A. | 分别加入盐酸10 mL时:c(X+)>c(M+)>c(Y+)>c(Cl-) | |
| B. | 分别加入盐酸15 mL时:c(Cl-)>c(X+)>c(MOH)>c(YOH) | |
| C. | 分别加入盐酸至pH=7时:c(X+)=c(M+)=c(Y+) | |
| D. | 将分别加入盐酸20 mL后的三种溶液混合:c(H+)+c(Y+)=c(OH-)+c(X+)+c(MOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给手机充电时:化学能转化为电能 | |
| B. | 铅蓄电池的放电过程:电能转化为化学能 | |
| C. | 氢气在氧气中燃烧:化学能转化为热能和光能 | |
| D. | 植物的光合作用:生物质能(化学能)转化为光能(太阳能) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com