
【题目】二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1= ________(用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp 的计算式为:![]() (Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向_______ (填“增大”、“不变”或“减小”)。
②某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
③200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为 _______(填标号)。
A.<![]() B.
B.![]() C.
C.![]() ~
~![]() D.
D.![]() E.>
E.>![]()
④300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律__________________________,原因_______________________。

(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①该电池的负极反应式为:_______________。
②某直接二甲醚燃料电池装置的能量利用率为 50%,现利用该燃料电池电解氯化铜溶液,若消耗 2.3g 二甲醚,得到铜的质量为_______ g。
【答案】ΔH4-2ΔH2- ΔH3 减小 > C 规律:压强增大,甲醇转化率减小 原因:压强增大,催化剂吸附水分子的量增多,催化效率降低 CH3OCH3 -12e-+3H2O=2CO2+12H+ 9.6g
【解析】
(1)结合已知热化学反应方程式,根据盖斯定律解答;
(2)①根据温度对2CH3OH(g)![]() CH3OCH3(g) + H2O(g)反应的平衡移动的影响分析;
CH3OCH3(g) + H2O(g)反应的平衡移动的影响分析;
②结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g),根据表格数据,比较Qp与Kp的大小,确定反应进行方向,进而判断正、逆反应速率的大小;
CH3OCH3(g) + H2O(g),根据表格数据,比较Qp与Kp的大小,确定反应进行方向,进而判断正、逆反应速率的大小;
③200℃时,根据![]() (Kp 为以分压表示的平衡常数,T为热力学温度)计算平衡时Kp,结合反应2CH3OH(g)
(Kp 为以分压表示的平衡常数,T为热力学温度)计算平衡时Kp,结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)判断达平衡状态时体系中CH3OCH3(g)的物质的量分数;
CH3OCH3(g) + H2O(g)判断达平衡状态时体系中CH3OCH3(g)的物质的量分数;
④300℃时,根据图1中曲线随压强的变化分析变化规律;
(3)①该电池为燃料电池,燃料电池中一般燃料做负极,燃料燃烧生成二氧化碳和水,据此书写负极反应式;
②计算2.3g 二甲醚完全燃烧时转移电子的物质的量,再根据电子守恒计算生成铜的质量。
(1)已知:①2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
②CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
③3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
由盖斯定律可知,③-①×2-②得2CH3OH(g)![]() CH3OCH3(g) + H2O(g)ΔH1=ΔH4-2ΔH2- ΔH3;
CH3OCH3(g) + H2O(g)ΔH1=ΔH4-2ΔH2- ΔH3;
(2)①![]() ,则Kp=
,则Kp=![]() ,温度越高,
,温度越高,![]() 越小,
越小,![]() 越小,即Kp越小,反应向逆向进行倾向增大,则CH3OH(g)脱水转化为二甲醚的倾向减小;
越小,即Kp越小,反应向逆向进行倾向增大,则CH3OH(g)脱水转化为二甲醚的倾向减小;
②结合反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)可知Qp=
CH3OCH3(g) + H2O(g)可知Qp=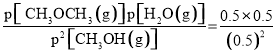 =1<Kp=100,则反应正向进行,则v正 >v逆;
=1<Kp=100,则反应正向进行,则v正 >v逆;
③200℃时,根据:![]() =
=![]() 3.52,则Kp>1。若反应初始投入CH3OH(g)1mol,完全反应全部转化为CH3OCH3(g)和H2O(g),根据反应比例关系,CH3OCH3(g)和H2O(g)各占一半,即CH3OCH3(g)的物质的量分数为
3.52,则Kp>1。若反应初始投入CH3OH(g)1mol,完全反应全部转化为CH3OCH3(g)和H2O(g),根据反应比例关系,CH3OCH3(g)和H2O(g)各占一半,即CH3OCH3(g)的物质的量分数为![]() ,由于反应为可逆反应,不可能完全转化,反应平衡时,CH3OCH3(g)的物质的量分数小于
,由于反应为可逆反应,不可能完全转化,反应平衡时,CH3OCH3(g)的物质的量分数小于![]() ;如果平衡时三种物质的含量相同,即均为1/3,由于反应前后体积不变,则此时Kp=1,因此要使Kp>1,则CH3OCH3(g)的物质的量分数一定大于
;如果平衡时三种物质的含量相同,即均为1/3,由于反应前后体积不变,则此时Kp=1,因此要使Kp>1,则CH3OCH3(g)的物质的量分数一定大于![]() 。答案选C;
。答案选C;
④300℃时,根据图1中曲线随压强的变化规律:当压强越大,甲醇转化率减小;根据反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g),反应前后气体体积不变,平衡不随压强的变化发生移动,出现该图曲线变化的原因是:压强增大,催化剂吸附水分子的量增多,催化效率降低;
CH3OCH3(g) + H2O(g),反应前后气体体积不变,平衡不随压强的变化发生移动,出现该图曲线变化的原因是:压强增大,催化剂吸附水分子的量增多,催化效率降低;
(3)①该电池为燃料电池,燃料电池中一般燃料做负极,负极发生氧化反应,燃料燃烧生成二氧化碳和水,结合装置如图 2,负极反应式:CH3OCH3 -12e-+3H2O=2CO2+12H+;
②负极反应式为CH3OCH3 -12e-+3H2O=2CO2+12H+,2.3g 二甲醚物质的量为![]() =0.05mol,二甲醚燃料电池装置的能量利用率为50%时,转移电子的物质的量=0.05mol×12×50%=0.3mol,根据Cu2++2e-=Cu,则生成铜的物质的量=
=0.05mol,二甲醚燃料电池装置的能量利用率为50%时,转移电子的物质的量=0.05mol×12×50%=0.3mol,根据Cu2++2e-=Cu,则生成铜的物质的量=![]() ×0.3mol=0.15mol,质量为0.15mol×64g/mol=9.6g。
×0.3mol=0.15mol,质量为0.15mol×64g/mol=9.6g。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明醋酸是弱电解质的是 ( )
A. 醋酸能使石蕊溶液变红
B. ![]() 时.
时.![]() 醋酸的pH约为3
醋酸的pH约为3
C. 向醋酸中加入氢氧化钠溶液,溶液pH增大
D. 醋酸能与碳酸钙反应产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲装置中所含的是物质的量之比为1∶2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是

A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.BC段阴极产物和阳极产物的体积之比为2∶1
C.AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()

A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):

下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),△H增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:

已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在200℃和10MPa的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4和CH3OH的燃烧热分别784kJ/mol和628kJ/mol则2CH4(g)+O2(g)=2CH3OH(g) △H=___。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)CH3OCH3(g) +H2O(g) △H<0。
①某温度下,将2.0molCO(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是____。

A.P3>P2,T3>T2
B.P1>P3,T1>T3
C.P1>P4,T2>T3
D.P2>P4,T4>T2
②在恒容密闭容器里按体积比为1:3充入一氧化碳和氢 气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___。
A.氢气的转化率减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g)
2CO2(g) +N2(g)
①200K、pPa时,在一个容积为2L的恒温密闭容器中充入1.5molNO和2.0molCO,开始反应至2min时测得CO转化率为30%,则用N2表示的平均反应速率为υ(N2)=___;反应达到平衡状态时,测得二氧化碳为0.8mol,则平衡时的压强为起始压强的__倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH__0(填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2-t1=t3-t2)则下列说法不正确的是__(填编号)
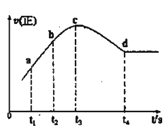
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:t1~t2 > t2~t3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0 mol PCl3和1.0 mol Cl2充入体积不变得密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g),达平衡时,PCl5为0.4mol,如果此时再充入2.0mol PCl3和1.0mol Cl2,再相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g),达平衡时,PCl5为0.4mol,如果此时再充入2.0mol PCl3和1.0mol Cl2,再相同温度下再达平衡时PCl5的物质的量是( )
A.0.4molB.0.8mol
C.大于0.8molD.大于0.4mol,小于0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com