
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
分析 溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,
当溶液中c(H+)>c(OH-)时,溶液呈酸性;
当溶液中c(H+)=c(OH-)时,溶液呈中性;
当溶液中c(H+)<c(OH-)时,溶液呈碱性,
注意不能根据溶液的pH值大小判断,若为非电解质溶于水,溶液为中性溶液.
解答 解:溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性
A、pH=7的溶液不一定呈中性,如100℃时,水的离子积常数是10-12,pH=6时溶液呈中性,当pH=7时溶液呈碱性,故A错误;
B、非电解质不电离,水溶液显中性,非电解质溶于水得到的溶液不一定显示中性,如非电解质二氧化碳溶于水形成碳酸为电解质,溶液为酸性,故B错误;
C、由强酸和强碱等物质的量反应得到的物质不一定是中性溶液,日硫酸与氢氧化钠等物质的量反应,故C错误;
D、溶液中c(H+)=c(OH-),溶液就呈中性,故D正确;
故选D.
点评 本题考查溶液酸碱性的判断,该题是常识性知识的考查,题目难度中等,该题的关键是明确溶液酸碱性的判断依据,注意溶液的酸碱性是根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断的,本题有利于培养学生的逻辑推理能力和灵活应变能力.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=6的降雨是酸雨 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | SO2和HClO都具有漂白性,两者的漂白原理相同 | |
| D. | 我国城市环境中的大气污染物主要有SO2、NO2、可吸入颗粒物等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | X和Y形成的原子个数比为1:1的分子中极性键和非极性键之比为2:1 | |
| C. | Z元素在自然界中存在游离态 | |
| D. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | T | |
| L |
| A. | 原子半径:X<Y<Z<T<L | |
| B. | 气态氢化物的还原性:L>Z>T | |
| C. | 含x的两种盐溶液混合可能生成沉淀 | |
| D. | Y的含氧酸的酸性小于T的含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是相同的 | |
| C. | MgO和Al2O3常用于制作耐高温材料,工业上采用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖溶液能产生丁达尔效应 | B. | 福尔马林可用于食品的防腐保鲜 | ||
| C. | 医用酒精可用于饮用水消毒 | D. | 淀粉、油脂、蛋白质可提供营养 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
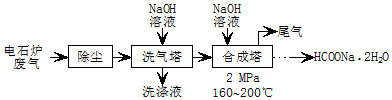
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com