
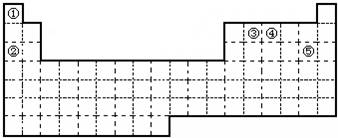
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
分析 (1)根据元素周期表的结构分析;
(2)根据元素金属性和非金属的递变规律解答;
(3)根据元素最高价氧化物对应水化物的递变规律或元素的金属性、非金属性的递变规律思考.
解答 解:(1)根据元素周期表的结构可知:①、⑥、⑦分别在第二周期VA、第三周期IIA和第三周期VIA,则①、⑥、⑦分别为N、Si、S,故答案为:N;
(2)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(③)和K(⑩)中K最活泼;在VII元素Cl(⑧)和Br中,Cl最活泼;最不活泼的是⑨即Ar,故答案为:K;Ar;
(3)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价.因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4;元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH;在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,故答案为:HClO4、KOH、Al(OH)3.
点评 本题综合性较强,涵盖了元素周期表、元素性质的递变规律、元素金属性及非金属性强弱的判断方法等,要求用多方面的知识解决问题,能很好滴训练综合运用知识解决问题的能力.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O晶体和NH4Cl混合搅拌 | B. | 硫酸与氢氧化钠反应 | ||
| C. | 锌和盐酸反应 | D. | 氢气和氧气的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
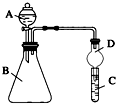 某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计如图系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
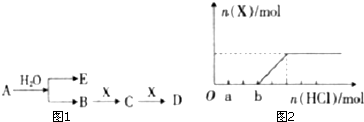
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,试比较②和③原子半径的大小②>③(填“>”或“<”)
,试比较②和③原子半径的大小②>③(填“>”或“<”)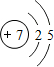 ,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.
,该元素的最高价氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)HNO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
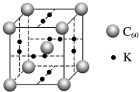 科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示.该化合物中的K原子和C60分子的个数比为( )
科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图所示.该化合物中的K原子和C60分子的个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂解与裂化的产物都含有不饱和烃 | |
| B. | 裂解与裂化都是烃的分解反应 | |
| C. | 裂解与裂化的原料都是石油分馏产品 | |
| D. | 裂解与裂化都是为得到气态烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com