
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )
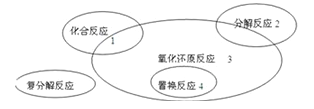
A.4Fe(OH)2+O2+2H2O=4Fe(OH)3
B.2H2O2![]() 2H2O+O2↑
2H2O+O2↑
C.3CO+Fe2O3![]() 3CO2+2Fe
3CO2+2Fe
D.Zn+H2SO4 = ZnSO4+H2 ↑
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水时电离方程式为:H3PO2![]() H++H2PO22-
H++H2PO22-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca(OH)2与Cl2反应的氧化物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应),生成物中含有Cl-、ClO-、ClO3-三种含氧元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线
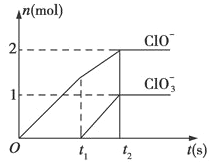
(1)t1前,氧化产物是___ ___(填化学式)。
(2)t2时,石灰乳与Cl2发生反应的总的离子方程式为:____ __。
(3)该反应中所消耗氯气的物质的量是______mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是__________(填字母)。
A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
_______Fe(OH)3+_______ClO-+_______OH-=_______FeO42-+_______Cl-+_______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某同学用500 mL容量瓶配制0.10 mol·L-1Na2CO3溶液的步骤:
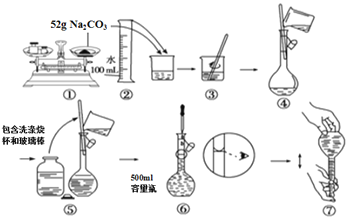
该同学的错误是
A. ①⑤⑥ B. ②④⑦ C. ①⑥ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1=-395kJ/mol,
CO(g)+1/2O2(g)=CO2(g) △H2=-283kJ/mol,
则反应C(s)+1/2O2(g)=CO(g)的反应热△H3等于 ( )
A. -112 kJ/mol B. -395 kJ/mol C. + 112 kJ/mol D. -283 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
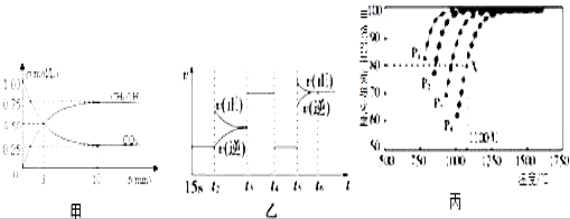
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使![]() 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmolA2的同时消耗n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述正确的是
A. 1 mol/L氯化铜溶液中的Cu2+数小于NA
B. 标准状况下,22.4 L Cl2与水反应转移的电子数为NA
C. 28 g聚乙烯含有的碳原子数为2NA
D. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com