
分析 加热碳酸钠和碳酸氢钠的混合物,加热至质量不再减少为止,碳酸氢钠完全分解,根据反应的方程式2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O利用差量法计算出碳酸氢钠的质量,然后计算出原混合物中碳酸钠的质量百分含量.
解答 解:碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,
设混合物中含有xgNaHCO3,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84 62
xg 190g-128g=62g
则:x=$\frac{84×2×62g}{62}$=168g,
所以m(Na2CO3)=190g-m(NaHCO3)=190g-168g=22g,
原混合物中碳酸钠的质量百分含量为:$\frac{22g}{190g}$×100%≈11.6%,
答:原混合物中碳酸钠的质量百分含量为11.6%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握差量法在化学计算中的应用,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | C4H10和C2H4 | B. | C2H6和C2H4 | C. | CH4和C3H4 | D. | C2H4和C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA | |
| B. | 0.1mol/L的 CaCl2溶液中所含Cl-数为0.2NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温常压下,8g CH4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、SO42-、NO3- | B. | Mg2+、Fe2+、NO3-、I- | ||
| C. | K+、Na+、Al3+、SO42- | D. | K+、Na+、SO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=5 | |
| B. | 每生成16 mol N2转移10 mol电子 | |
| C. | N2既是氧化产物又是还原产物 | |
| D. | 反应中氧化产物与还原产物的质量之比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该物质为离子晶体 | |
| B. | 该物质可用通过C60吸附N2而制得 | |
| C. | C(N3)4中碳元素为正价 | |
| D. | 18g该物质完全分解可以产生13.44升(标准状况)氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
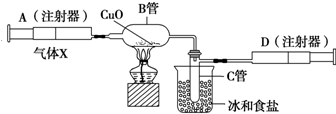 如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com