
| A. | 甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
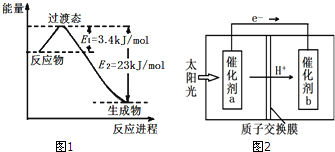 空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 温度(℃) | 300 | 500 | 700 |
| K | 3.00 | 3.47 | 4.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以加快制取氢气的速度 | Ⅰ对、Ⅱ对、无 |
| B | 用Mg-Al-NaOH构成原电池 | Mg更活泼作负极 | Ⅰ对、Ⅱ对、无 |
| C | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | Ⅰ对、Ⅱ对、有 |
| D | MgCl2是离子化合物 | 电解MgCl2的饱和溶液制取金属镁 | Ⅰ对、Ⅱ对、有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2O2中含有的阴离子数目为0.1NA | |
| B. | 常温下,34gH2O2中H-O键数目为2NA | |
| C. | 1.00mol NaCl晶体中含有NA个NaCl分子 | |
| D. | 在20g D216O中含有10 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C与C60互为同素异形体 | ||
| C. | 15N与14N互为同位素 | D. | 15N和14N的化学性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com