
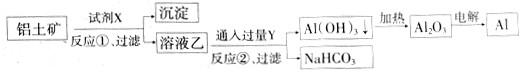
| A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| B.反应①、过滤后所得沉淀为Fe2O3 |
| C.图中所示转化反应都不是氧化还原反应 |
| D.试剂X可以是氢氧化钠溶液 |
科目:高中化学 来源:不详 题型:单选题
| A.7.04g | B.8.26g | C.8.51g | D.9.02g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①②③④ | B.只有④⑤⑥ | C.只有①③⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.只有① | C.②④ | D.①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲中沉淀一定比乙中的多 |
| B.甲中沉淀可能比乙中的多 |
| C.甲中沉淀一定比乙中的少 |
| D.实验过程中甲中和乙中的现象始终保持一致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
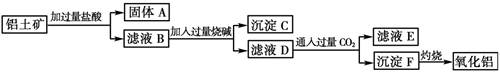
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com