
分析 (1)CO2通入Na2CO3溶液中,发生Na2CO3+CO2+H2O=2NaHCO3,20℃时,Na2CO3溶解度为21.8g,NaHCO3溶解度为9.6g,根据反应方程式以及21.2gNa2CO3溶于103.6g水中配成溶液的条件求解,沉淀为NaHCO3,结合数据求解析出晶体的质量;
(2)最后溶液体积为100mL为饱和溶液,剩余水为:103.6g-0.2mol×18g/mol=100g,NaHCO3溶解度为9.6g,应溶解9.6gNaHCO3,根据n=$\frac{m}{M}$、C=$\frac{n}{v}$求解溶液的物质的量浓度.
解答 解:(1)21.2gNa2CO3的物质的量为n=$\frac{m}{M}$=$\frac{21.2g}{106g/mol}$=0.2mol,在Na2CO3溶液中通入足量二氧化碳气体发生Na2CO3+CO2+H2O=2NaHCO3,0.2molNa2CO3消耗0.2molH2O,生成0.4molNaHCO3,m(NaHCO3)=nM=0.4mol×84g/mol=33.6g,剩余水为:103.6g-0.2mol×18g/mol=100g,NaHCO3溶解度为9.6g,应溶解9.6gNaHCO3,析出NaHCO3:33.6g-9.6g=24g,
故答案为:有;24;
(2)析出NaHCO3:33.6g-9.6g=24g,最后100mL溶液中,9.6gNaHCO3的物质的量为n=$\frac{m}{M}$=$\frac{9.6g}{84g/mol}$≈0.1143mol,则20℃时,NaHCO3饱和溶液物质的量浓度约为C=$\frac{n}{v}$=$\frac{0.1143mol}{0.1L}$≈1.14mol/L,
故答案为:1.14.
点评 本题考查Na2CO3、NaHCO3性质,侧重于学生的分析能力的考查,为高频考点,注意把握Na2CO3和NaHCO3性质的异同,该题注意溶解度性质,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液于水时仅破坏了离子键而未破坏共价键 | |
| B. | NH4Cl溶解于水时不仅破坏了离子键还破坏了共价键 | |
| C. | H2SO4溶解于水时,所有的共价键都被破坏 | |
| D. | HCl溶解于水时电离出H+和Cl-,所以共价键变成了离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O | |
| B. | 若乙池中为足量AgNO3溶液,则阳极的电极反应为:4OH--4e-═2H2O+O2↑ | |
| C. | 若乙池中为一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为0.2NA | |
| D. | 常温常压下,1gCH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:CH3OH(l)+1.5O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
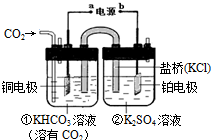
| A. | 该过程是电能转化为化学能的过程 | |
| B. | 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O | |
| C. | 一段时间后,②池中溶液的pH一定增大 | |
| D. | 盐桥中K+移向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D能形成5种以上单质 | |
| B. | X、Y、Z三种化合物的熔沸点逐渐升高 | |
| C. | X、Y、Z的稳定性逐渐减弱 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )共聚而成,则单体A可能为( )
)共聚而成,则单体A可能为( )| A. | C2H5-CH═CH-CH3 | B. |  | C. |  | D. | CH3C═CH-CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
向铁铜合金中加入硝酸溶液恰好完全反应,得到NO2、N2O4、NO混合气体,向反应后溶液中加入2mol/LNaOH溶液,至沉淀恰好完全。若将得到的NO2、N2O4、NO混合气体,与2.24L(标准状况下)O2混合后通入水中恰好被完全吸收生成硝酸。则反应中消耗的NaOH溶液的体积是
A.150ml
B.180ml
C.200ml
D.250ml.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com