
【题目】下列说法正确的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.化学反应中的能量变化,通常表现为热量的变化
D.木炭在氧气中的燃烧是吸热反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】检验某未知溶液中是否含有SO42-的下列操作中,最合理的是()
A.先加硝酸酸化,再加氯化钡溶液B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液D.先加盐酸酸化,再加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中有浓度均为0.01molL﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38;Ksp[Cr(OH)3]=7.0×10﹣31 , Ksp[Zn(OH)2]=1.0×10﹣17;Ksp[Mg(OH)2]=1.8×10﹣11 . 当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s) + 2B(g)![]() C(g) + D(g) 已达平衡状态的是
C(g) + D(g) 已达平衡状态的是
A. 混合气体的压强 B. 混合气体的密度
C. B的物质的量浓度 D. 气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(s)的能量变化如图所示,下列叙述正确的是( ) 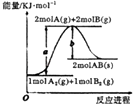
A.该反应为放热反应
B.加催化剂能降低该反应焓变
C.A﹣B的键能为bkJmol﹣1
D.该反应的反应热为△H=(a﹣b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
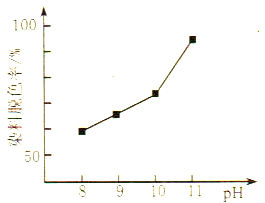
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
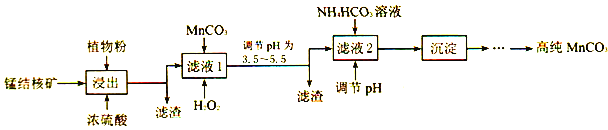
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
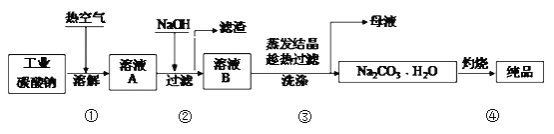
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是

A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com