
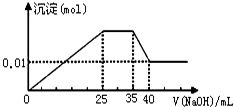
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:| 离子 | H+ | NH4+ | K+ | Mg2+ | Cu2+ | Al3+ |
| c/mol?L-1 |
| 6.99g |
| 233g/mol |
| 6.99g |
| 233g/mol |
| 0.01mol |
| 0.1L |
| 0.02mol |
| 0.01L |
| 2mol/L×0.005L |
| 0.1L |
| 2mol/L×0.01L |
| 0.1L |
| 0.03mol |
| 0.1L |
| 离子 | H+ | NH4+ | K+ | Mg2+ | Cu2+ | Al3+ |
| c/mol?L-1 | 0 | 0.2 | ? | 0.1 | 0 | 0.1 |
| 0.02mol |
| 0.01L |


科目:高中化学 来源: 题型:
| X | ||||
| Y | Z | W |
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
| B、Z的最高价氧化物的水化物酸性比W的强 |
| C、X的简单气态氢化物的稳定性比W的弱 |
| D、X分别与Y、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
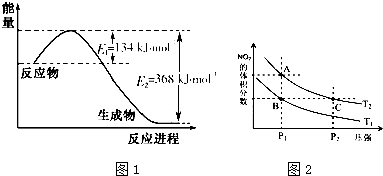 氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用.| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:
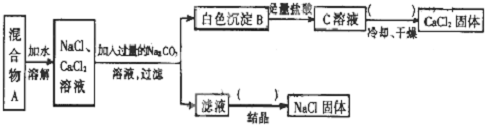
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 |
| C、油脂和纤维素都是能发生水解反应的高分子化合物 |
| D、甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com