
| A. | 化合反应 | B. | 复分解反应 | C. | 置换反应 | D. | 分解反应 |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:实验题
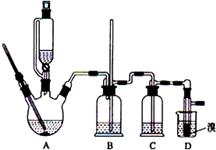 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 液溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红色发烟液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.12 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 水滴石穿:CO2+CaCO3+H2O═Ca(HCO3)2 | |
| C. | NH4Cl溶解在T2O中:NH4++T2O?NH3•T2O+H+ | |
| D. | 乙烷的燃烧热为-1559.9 kJ•mol-1,则乙烷燃烧的热化学方程式可表示为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-3119.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应达到平衡时所用的时间越短 | |
| B. | K越小,达到平衡时,反应物的 转化率越大 | |
| C. | K随反应物浓度改变而改变 | |
| D. | K越大,达到平衡时,反应进行的程度越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 用焰色反应鉴别NaCl和KCl | |
| C. | 用丁达尔效应鉴别硫酸钠溶液和硅酸胶体 | |
| D. | 用排水集气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 92.3% | B. | 75% | C. | 66.75% | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放 | |
| D. | 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com