

分析 (1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利原理;
(2)原子数目相等、价电子总数相等的微粒互为等电子体;甲醇分子中C原子价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化类型;
(3)Cu是29号元素、Zn是30号元素,Cu、Zn原子中3d、4s能级上电子为其外围电子,根据构造原理书写其原子外围电子排布式;
(4)甲醛和新制氢氧化铜悬浊液发生氧化反应生成碳酸钠、氧化亚铜和水;
①根据均摊法可知,晶胞中大球数目为2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,结合氧原子配位数确定;
②结合晶胞含有原子数目计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度
解答 解:(1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利原理,
故答案为:错误;违背泡利原理;
(2)CO分子中含有2个原子、价电子数是10个,则与CO互为等电子体的是CN-、C22-,甲醇分子中C原子价层电子对个数是4,所以C原子杂化方式为sp3,故答案为:CN-、C22-;sp3;
(3)Cu是29号元素、Zn是30号元素,Cu、Zn原子中3d、4s能级上电子为其外围电子,根据构造原理书写其原子外围电子排布式分别为铜3d104s1、锌3d104s2 ,故答案为:铜3d104s1;锌3d104s2 ;
(4)在加热条件下,甲醛和新制氢氧化铜悬浊液发生氧化反应生成碳酸钠、氧化亚铜和水,反应方程式为HCHO+4Cu(OH)2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2Cu2O+6H2O,
故答案为:HCHO+4Cu(OH)2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2Cu2O+6H2O;
①根据均摊法可知,晶胞中大球数目为2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,氧原子配位数为4,则该晶胞中,Cu+的配位数是2,
故答案为:2;
②晶胞质量为$\frac{16×2+64×4}{{N}_{A}}$g,晶胞密度=$\frac{16×2+64×4}{{N}_{A}}$g÷(a×10-10cm)3=$\frac{16×2+64×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:$\frac{16×2+64×4}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布、等电子体等知识点,侧重考查学生分析计算及应用能力,明确物质结构、基本理论是解本题关键,难点是晶胞计算,题目难度中等,注意(4)题单位换算,为易错点.


科目:高中化学 来源: 题型:解答题
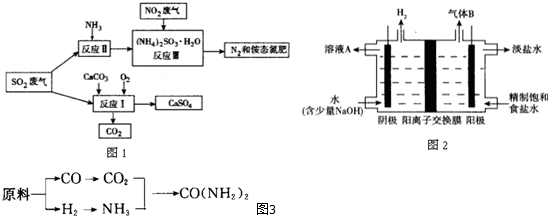
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56gFe与1 molCl2充分反应转移电子数为3NA | |
| B. | 常温常压下,22 g D3O+含有10 NA个电子 | |
| C. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02 NA | |
| D. | 1 L0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
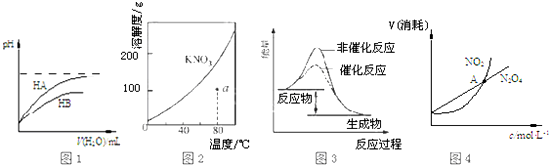
| A. | 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| B. | 图2表示 KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| C. | 图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 测同温同浓度下的Na2CO3和Na2SO3水溶液的pH | 确定碳和硫两元素非金属性强弱 |
| B | 向CH2=CHCH2OH中滴加酸性KMnO4溶液 | 证明CH2=CHCH2OH中含有碳碳双键 |
| C | 取久置的Na2SO3溶于水,加硝酸酸化的BaCl2溶液 | 证明Na2SO3部分被氧化 |
| D | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 | 检验蔗糖水解产物具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
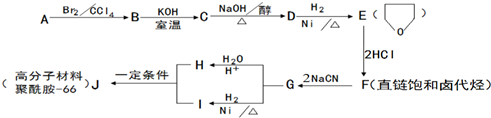
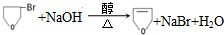 .
.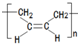 .
. .
.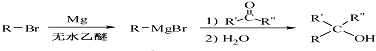
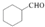 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: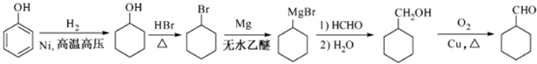 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com