
 草酸与高锰酸钾在酸性条件下能够发生如下反应:
草酸与高锰酸钾在酸性条件下能够发生如下反应:| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
| W |
| 5 |
| W |
| 5 |
| 2 |
| 0.02L×c |
| 5×134g | ||
|
| 2W |
| 67 |
| 2W |
| 67 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液:Fe3+、K+、OH-、NO3- |
| B、与Al反应生成H2的溶液:Na+、Ma2+、NO3-、HCO3- |
| C、c(OH-)=1mol/L的溶液:K+、Ca2+、Cl-、H2SO3 |
| D、CH3COOH:SO42-、Cl-、Cu2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
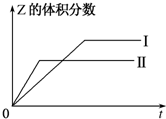 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解度:Na2CO3大于NaHCO3 |
| B、稳定性:Na2CO3大于NaHCO3 |
| C、与酸反应剧烈程度:NaHCO3大于Na2CO3 |
| D、石灰水可与Na2CO3反应而不与NaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后再停止加热 |
| B、蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上口进下口流出 |
| C、过滤后洗涤沉淀时,应将固体转移至烧杯中,并加入适量蒸馏水充分搅拌后再过滤 |
| D、分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从上口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A、一定没有Cu2+、NO3-、Cl- |
| B、可能有K+、NH4+、NO3-、SO42- |
| C、不能确定是否含有K+、NO3- |
| D、一定有Mg2+、Al3+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com