
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 | |
| 开始沉淀时 | 3.8 | 5.8 | 2.2 | 10.6 |
| 完全沉淀时 | 4.7 | 8.3 | 4.0 | 12 |
分析 以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3),由流程可知,加硫酸溶解Fe3O4、SiO2不溶,CaO转化为微溶于水的CaSO4,“净化除杂”需先加H2O2溶液,将亚铁离子转化为铁离子,调节溶液的pH约为5,使铁离子、铝离子均转化为沉淀,则滤渣为氢氧化铝、氢氧化铁,然后蒸发浓缩、冷却结晶、过滤分离出H3BO3,以此来解答,
(1)Mg2B2O5•H2O与硫酸反应生成硫酸镁和硼酸;
(2)为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径等;
(3)双氧水具有氧化性,能将还原性亚铁离子氧化生成铁离子;条件溶液的pH在5左右时Fe3+、Al3+均转化为沉淀;
(4)最后浓缩结晶时硫酸镁易结合水以晶体析出,则“粗硼酸”中的主要杂质是硫酸镁;
解答 解:(1)Mg2B2O5•H2O与硫酸反应的化学方程式:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4,
故答案为:Mg2B2O5•H2O+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2H3BO3+2MgSO4;
(2)为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有提高反应温度或减小铁硼矿粉粒径等,
故答案为:升高温度、适当增大硫酸的浓度或减小铁硼矿粉的粒径等;
(3)“净化除杂”需先加H2O2溶液,作用是将亚铁离子氧化为铁离子.然后在调节溶液的pH约为5,目的是使铁离子、铝离子形成氢氧化物沉淀而除去,
故答案为:将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物沉淀而除去;
(4)最后浓缩结晶时硫酸镁易结合水以晶体析出,则“粗硼酸”中的主要杂质是硫酸镁,
故答案为:MgSO4 ;
点评 本题考查物质分离和提纯的综合应用,为高频考点,涉及基本实验操作、化学用语、氧化还原反应等知识点,把握实验流程及发生的反应、混合物分离提纯方法为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
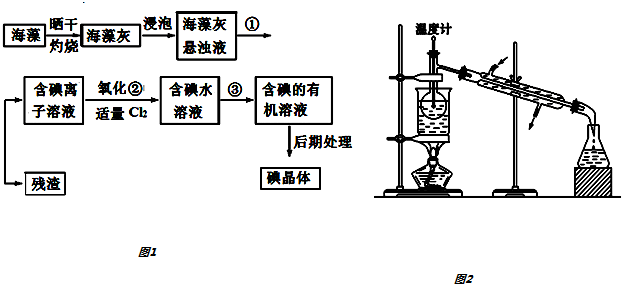
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
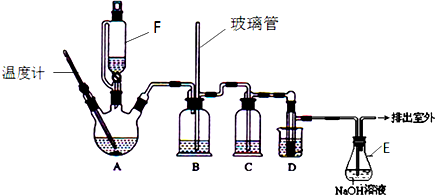
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料的脱硫脱硝技术可以减少SO2、NOx的排放 | |
| B. | PM2.5是直径≤2.5微米的细颗粒物,其表面积大,易附带有毒有害物质 | |
| C. | O3能消毒杀菌,空气中O3浓度越大越有利于人体健康 | |
| D. | 汽车尾气中的CO主要来自汽油的不完全燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2?N2O4 (正反应为放热反应) | |
| B. | C(s)+CO2?2CO (正反应为吸热反应) | |
| C. | N2+3H2?2NH3 (正反应为放热反应) | |
| D. | H2S?H2+S(s) (正反应为吸热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com