
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)![]() 2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) H< 0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A.升高温度,X的物质的量减小
B.增大压强(缩小容器体积),Z的浓度不变
C.保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,重新平衡时,Y的体积分数增大
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z 四种短周期元素,它们在周期表中位置如图所示,下列说法正确的是
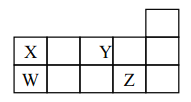
A. 四种元素中原子半径最大为 W, Y 的氢化物稳定性最强
B. 四种元素最高价氧化物的水化物都是酸
C. XZ4、 WY2中所含化学键类型相同,熔点都很高
D. W、 X 形成的单质都是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
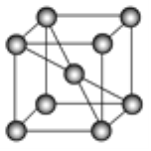
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是

A. X的最常见气态氢化物的水溶液显碱性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)碳的一种同位素原子核内有8个中子,则该原子的符号为________,其质量数为______。
(2)用电子式表示CaCl2的形成过程______________________________和H2S的形成过程______________________________。
(3)A-、B2-、C+、D2+四种离子的电子数均为10。其原子半径由大到小的顺序为____________(填元素符号),其离子半径由大到小的顺序为____________(填离子符号)
(4)10g D2O的物质的量为_______,它与_______gCH4所含电子数相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)及其化合物有许多优良性能,被广泛用于冶金、化工等领域。
(1)碲(Te)在周期表中的位置为________________________。碲化氢的还原性比H2S的还原性__________(填“强”或“弱”)。
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为__________;
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为____________________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图:
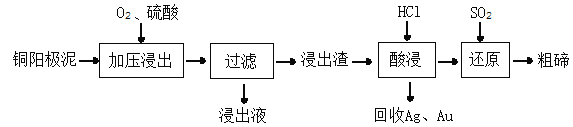
①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式________________________,该过程中,应控制溶液的pH为4.5~5.0,酸性不能太强的原因是__________________________。
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式______________________。
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室保存下列物质的方法中,不正确的是( )
A.少量金属钠保存在煤油里
B.浓硫酸存放在广口试剂瓶中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.氯水应装在棕色细口瓶中密封避光保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com