
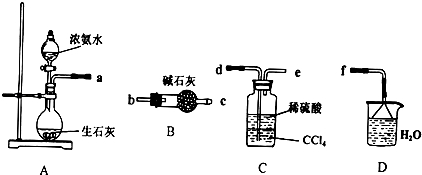
 浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:分析 废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐,以此分析解答;
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤;
(2)遵循“左物右码”原则;
(3)Fe2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,根据关系式5Fe2+~MnO4-,计算4g产品中Fe2+的物质的量,进而计算Fe2+的质量,再根据质量分数定义计算;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸.
解答 解:废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐;
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤,
故答案为:防止Fe2+离子被氧化为Fe3+离子;b;冷却结晶;
(2)遵循“左物右码”原则,药品应放置在左盘内,将莫尔盐晶体放在托盘天平左盘进行称量时,天平指针向右偏转,说明砝码重,样品轻,
故答案为:砝码重,样品轻;
(3)测定摩尔盐产品中Fe2+的含量,采用在酸性条件下KMnO4标准液滴定,Fe2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2++系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为:5Fe2++MnO4-+8H+=1Mn2++5Fe3++4H2O,
设4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.2mol/L
x=$\frac{0.01L×0.2mol/L×5}{1}$=0.01mol,
所以4g产品中Fe2+的质量0.01mol×56g/mol=0.56g,所以4g产品中Fe2+的质量分数为:$\frac{0.56g}{4g}$×100%=14%,
故答案为:14%;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f,分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸,
故答案为:d、e、f;分液;吸收多余的NH3防止污染空气,防止倒吸.
点评 本题考查化学工艺流程、盐类水解、化学实验等,难度中等,需要学生具有扎实的基础与运用知识分析解决问题的能力,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\underset{\stackrel{\;}{C}}{•}$H2O | B. | $\underset{\stackrel{\;}{N}}{•}$2H4 | C. | $\underset{\stackrel{\;}{B}}{•}$F3 | D. | $\underset{\stackrel{\;}{C}}{•}$2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
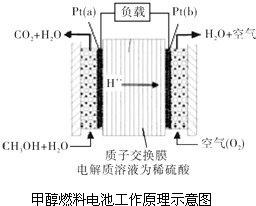 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人们生活质量的提高以及社会发展有着密切的关系.
化学与人们生活质量的提高以及社会发展有着密切的关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使它转化为较稳定物质,便于保存和运输 | |
| B. | 增强漂白和消毒作用 | |
| C. | 使转化为较易溶于水的物质 | |
| D. | 增加氯的质量分数,有利于漂白、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油里的原因之一是它极易与氧气反应 | |
| B. | 铝在空气中很容易燃烧 | |
| C. | 镁表面的氧化膜疏松,不能保护内层金属 | |
| D. | 铁锈的主要成分是Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com