
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
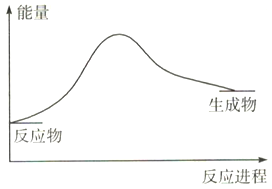
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
【答案】 旧化学键的断裂与新化学键的形成 O-H、N≡N 吸热 > C+CO2![]() 2CO(其他合理答案均可)
2CO(其他合理答案均可)
【解析】(1)从化学键角度上看,化学反应的本质为旧化学键的断裂与新化学键的形成;根据2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应中断裂的化学键有O-H、N≡N,根据图示,反应物的总能量低于生成物的总能量,该反应是吸热反应,则4NH3(g)+3O2(g)
4NH3(g)+3O2(g),反应中断裂的化学键有O-H、N≡N,根据图示,反应物的总能量低于生成物的总能量,该反应是吸热反应,则4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)为放热反应,反应中反应物的总能量>生成物的总能量;故答案为:旧化学键的断裂与新化学键的形成;O-H、N≡N;吸热;>;
2N2(g)+6H2O(1)为放热反应,反应中反应物的总能量>生成物的总能量;故答案为:旧化学键的断裂与新化学键的形成;O-H、N≡N;吸热;>;
(2)属于吸热反应的有氢氧化钡晶体与氯化铵固体的反应、碳与二氧化碳的反应,氢气还原氧化铜的反应等,故答案为:C+CO2![]() 2CO(其他合理答案均可)。
2CO(其他合理答案均可)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硅是信息技术的关键材料,在工业中可利用镁制取硅:2Mg(过量)+SiO2![]() 2MgO+Si,2Mg+Si
2MgO+Si,2Mg+Si![]() Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体。
Mg2Si(副反应),查资料得:①Mg2Si遇盐酸迅速反应生成SiH4(硅烷);②SiH4在常温下是一种不稳定易分解、易自燃的气体。
I.如图是实验室进行Mg与SiO2反应的裝置:

(1)盛放稀硫酸的装置为____,由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用___(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)当反应开始后,移走酒精灯反应能继续进行,其原因是_________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为①___________;②_____________。
II.利用如图装置(量气管“0”刻度在刻度线的最上方)可测定生成物的纯度。

(4)实验开始前应先__________。
(5)若取样品Wg加入5mLNaOH(足量)充分反应。反应前量气管液面读数为V1mL,反应后为V2mL(实验数据均转化为标准状况下),则样品的纯度为_____(写出计算式,不化简)。
(6)若反应结束时读数前未调节量气装置两边液面高度相平(右边的液面高于左边液面),则会导致实验结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2+O22SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:

回答下列问题:
(1)二氧化碳分子中的化学键是_________________,物质乙的化学式是______________。
(2)写出反应①的化学方程式__________________________________。
(3)实验室常用纯净碳酸钙与稀盐酸反应制取二氧化碳气体,反应过程中产生二氧化碳的速率V(CO2) 与时间关系如下图:

①由图像分析,化学反应速率最快一段是___________。
②为了增大上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是_________(填写序号)。
A.蒸馏水 B.氯化钠溶液 C.浓盐酸 D.加热
(4)二氧化碳能与氢氧化钠溶液反应,当氢氧化钠过量时反应生成碳酸钠,当氢氧化钠少量时反应生成碳酸氢钠。当二氧化碳与氢氧化钠反成的物质的量比为2:3时,溶液中的溶质是_______________。
(5)从原子结构角度说明氧原子得电子能力强于碳原子:___________________________________。
(6)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
CH3OH(g)+H2O(g)。 将a molCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,t min时测得甲醇的物质的量为c mol。计算0-t min内CO2的反应速率为_________ mol·L-1·s-1。 [X 的反应速率ν(X)=X的物质的量浓度变化/变化需要的时间]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X,Y,Z三种气体的起始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na+、K+、Cl-、NO3- D. Ba2+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀盐酸 | 锌粒 | H2 | NaOH溶液 |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJmol﹣1 ,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=﹣657.01kJmol﹣1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=﹣625.63kJmol﹣1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
A.2.43×104 kJ
B.2.35×104 kJ
C.2.23×104 kJ
D.2.14×104 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时pH=12的NaOH溶液100mL.,欲用以下几种方法将其pH调整到11,回答下列问题(已知混合后溶液的总体积等于混合前两稀溶液的体积之和):
(1)25℃时,pH=12的NaOH溶液中由水电离产生的c(OH﹣)=
(2)加水稀释,需加水的体积为mL.
(3)加入pH=2的盐酸,需加盐酸的体积为mL.(精确到0.1)
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com