
| 元素 | 相关信息 |
| A | 原子的核外电子数和电子层数相等 |
| B | 基态原子价电子排布为nsnnpn |
| C | 气态氢化物与最高价氧化物的水化物反应生成盐 |
| D | 基态原子电子排布有2个未成对电子 |
| E | 位于第三周期,在同周期中原子半径最大 |
| F | 与B 形成的合金为目前用量最多的金属材料 |
 ;
;
| ||
 ;分子;3CO+Fe2O3
;分子;3CO+Fe2O3
| ||
| c2(NH3) |
| c3(H2)?c(N2) |
| c2(NH3) |
| c3(H2)?c(N2) |
| ||
| 10min |
| 1 |
| 2 |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、0.24g | B、0.64g |
| C、0.4g | D、1.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3- |
| B、稀HNO3溶液:Na+、Mg2+、SO42-、Cl- |
| C、FeCl3溶液:K+、Na+、I-、SO42- |
| D、由水电离产生的c(H+)=10-13 mol?L-1的溶液:K+、Na+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| 甲同学:取少量(0.5~2mL)小烧杯中的溶液于洁净试管中,滴加1~2滴20%KSCN溶液 | ①若溶液显血红色,则假设 ②若溶液不发生颜色变化,则假设 |
乙同学: | ③若粉末 ④若粉末 ⑤若粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:
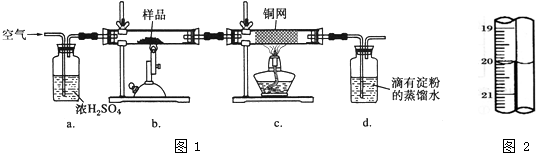
| 1 |
| 10 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
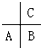 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| A、中子数为1 |
| B、质子数为2 |
| C、质量数为3 |
D、原子结构示意图是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com